Akciğer kanseri
Akciğer kanseri, akciğer dokularındaki hücrelerin kontrolsüz çoğaldığı bir hastalıktır. Bu kontrolsüz çoğalma, hücrelerin çevredeki dokuları sararak veya akciğer dışındaki organlara yayılmaları ile (metastaz) sonuçlanabilir. Dünya Sağlık Örgütünün (WHO) raporuna göre akciğer kanseri tüm dünyada kanser türleri arasında en sık ölüme neden olan kanser türüdür ve tüm dünyada her yıl yaklaşık 1,6 milyon ölüme neden olmaktadır.[1]
| Akciğer kanseri | |
|---|---|
 | |
|
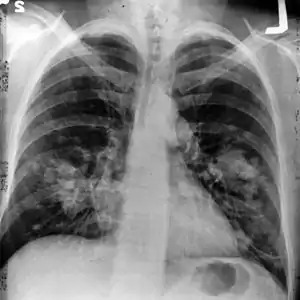
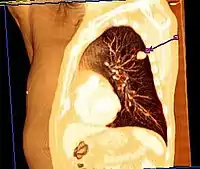
Ön-arka (sagital) eksende çekilmiş bir göğüs grafisinde, hastanın sol akciğerindeki olası bir akciğer kanserine ait oluşum kalp gölgesinin sol üstünde izleniyor. | |
| Uzmanlık |
Onkoloji |
Ölüm oranı (mortalitesi) oldukça yüksek olan bu kanser türünde dünya genelinde sigara içme alışkanlıklarındaki değişmeye bağlı olarak alttiplerinde ve kadınlarda görülme oranlarında değişimler olmuştur[2]. Akciğer kanserinin en sık nedeni uzun süreli olarak tütün dumanına maruz kalmak olmakla beraber[3], tüm akciğer kanserli hastaların %15'e ulaşan bir oranı sigara içmeyenlerden oluşmaktadır[4]. Akciğer kanseri birçok faktöre bağlı olarak ortaya çıkan bir hastalıktır. Bu nedenler arasında; genetik faktörler[5][6], radon gazı[7], asbest[8] ve hava kirliliği[9][10][11] gibi faktörler sorumlu tutulmaktadır.
Akciğer kanserinin belirtileri hastalığın nerede başladığına, nasıl yayılmış olduğuna, ve vücudun hastalığa tepkilerinin varlığına bağlı olarak fark edebilir[12]. En sık görülen belirtileri, nefes darlığı (dispne), öksürme (kanlı öksürme da dahil) ve kilo kaybıdır[13]. Bu belirtiler sadece akciğer kanserine özgü olmadıklarından hastaların tanı almaları gecikebilir. Akciğer kanseri, göğüs röntgeni ve bilgisayarlı tomografi (BT) ile görülebilir. Kesin tanı, biyopsi ile konmaktadır. Biyopsi genelde bronkoskopi veya BT-yardımlı biyopsi ile yapılır. Tedavi ve prognozu belirleyen faktörler; kanserin histolojik tipi, kanserin evresi, ve hastanın genel performans durumudur. Akciğer kanserinin birçok histolojik alttipi olmasına karşın, klinikte genellikle küçük hücreli ve küçük hücreli dışı akciğer kanseri olmak üzere iki başlıkta incelenir; çünkü tedavide izlenecek yolu bu gruplandırma belirler. Küçük hücreli akciğer kanseri tedavisinde kemoterapi ve radyoterapi tercih edilirken, küçük hücreli dışı kanserlerde ilk tercih cerrahidir.[14]
Akciğer kanserinin görülme oranı yaşla artar, genelde 50-70 yaşlarında görülür[15]. Akciğer kanserinin erken evrelerde beş yıllık sağkalımı %60-70 iken, ileri evre olgularda bu oran %5'in altına düşmektedir.[13] Tüm alttipler ve evreler göz önüne alındığında, tedavi ile beş yıllık sağ kalım oranı Amerika Birleşik Devletleri'nde %18,1'dir (2017 için);[16] ancak sağkalım oranları gelişmekte olan ülkelerde daha düşüktür.[17]
Sıklık ve yaygınlık
Tüm kanser türleri arasında en ölümcül kanser türü olan akciğer kanseri tüm dünyada kanser türleri arasında, erkeklerde en sık ölüme neden olan birinci, kadınlarda ise ikinci kanser türüdür[18] ve tüm dünyada her yıl yaklaşık 1,6 milyon ölüme neden olmaktadır.[1] Bununla beraber ABD'de hem kadın hem de erkeklerde ölüme sebep olan kanser türleri arasında 1. sıradadır[19]. Günümüzde akciğer kanseri, ABD'de kadınlarda ölüme sebebiyet veren kanser türleri arasında en önde gelenidir ve meme kanseri, yumurtalık ve yumurtalık tüpü kanserleri toplamından daha yaygındır[20]. Ancak ABD'de sigara içiminin azalması ile akciğer kanseri sıklığı da azalmaya başlamıştır. Buna karşılık Türkiye'de sigara içimi arttığı için artmaya devam etmektedir. Ancak, başka yönlerden sağlıklı olan ve hayatı boyunca sigara kullanmamış olan insanlar da akciğer kanserine yakalanabilmektedir.
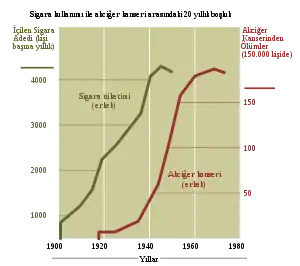
Akciğer kanseri, 20. yüzyılın başlarında nadir bir hastalık iken, bugün her iki cinsiyette de kanserden ölümlerin başında yer almaktadır. Mortalitesi oldukça yüksek olan bu kanser türünde dünya genelinde sigara içme alışkanlıklarındaki değişmeye bağlı olarak histolojik alttiplerinin oranında değişiklik yaşanmış ve kadınlarda sigara kullanımının zamanla artmasının sonucunda kadınlarda görülme sıklığında artma gözlenmiştir[2]. Tarihsel olarak çoğunlukla erkeklerde görülen bu kanser türü zaman içinde meydana gelen sosyolojik değişiklikler sonucunda, kadınların da sigara kullanma alışkanlıklarının artması sonucunda kadınlarda bu kanser türünün görülme sıklığı artmıştır[20].
Akciğer kanserinin küresel insidans artış hızı yılda %0,5 iken, özellikle kadınlarda her yıl %4,1 artış söz konusudur. Gelişmiş ülkelerde önceleri kanserden ölümlerin %34'ünden akciğer kanserleri sorumlu iken, günümüzde %28'inden sorumludur. Bu azalmaların nedeni gelişmiş ülkelerde sigara kullanımında belirgin azalma ve sigara içeriğinde yapılan değişikliklere bağlanmaktadır. Ancak gelişmekte olan ülkelerde sigara kullanımında azalma olmaması bilakis artması sonucunda hem erkeklerde hem de kadınlarda tüm kanser ölümleri içinde önemli yerini korumakta ve belirgin artış gözlenmektedir[22].
Belirti ve bulgular
Akciğer ve bronş sisteminin ağrı duyusu içermemesi ve ilk semptom olan öksürüğün sigara içenler tarafından bir hastalık belirtisi olarak değerlendirilmemesi nedeniyle, akciğer kanseri vakalarının tanısı çoğunlukla ileri evrelerde konulmaktadır. Semptomlar tümörün lokal büyümesine bağlı olabileceği gibi metastatik hastalığa veya metastatik olmayan kanserli hücrelerin vücudun diğer dokularına dolaylı etkilerine (paraneoplastik sendromlara) bağlı olabilir[23].
Semptomlar
Akciğer kanserinin semptomları birincil (primer) tümör tipine, tümörün göğüs kafesi içinde (intratorasik) dağılımına yayılımına, metastazlara veya paraneoplastik sendromlara bağlı olarak ortaya çıkar[12][24]. American Thoracic Society (ATS) ve European Respiratory Society'nin (ERS), çeşitli araştırmaların verilerine göre yaptığı ortak araştırmaların sonucunda; öksürük %8-75, kilo kaybı %0-68, nefes darlığı (dispne) %3-60, göğüs ağrısı %20-49 ve öksürükle kan tükürme (hemoptizi) %6-35 oranlarında görülebilmektedir[25].
Tanı konan hastaların %10[24] ile 25'e[26] varan oranlarda asemptomatiktir yani herhangi bir semptom göstermez. Böyle hastalarda kanser tanısı, tesadüfen çekilen akciğer röntgeni veya bilgisayarlı tomografide saptanan soliter pulmoner nodüllerin incelenmesiyle tanı konmaktadır. Kanserin büyümesi ve akciğer dokusuna yayılması sonucunda öksürük, nefes darlığı, hışıltılı solunum (wheezing), göğüs ağrısı, hemoptizi semptomları görülür. Akciğer kanserinin metastazları ise yayılım gösterdiği organa bağlı olarak bulgu verir. Bu kanserin, beyine yaptığı metastaz nörolojik semptomlara neden olurken, kemiğe metastazıyla ağrı şikayetleri görülür. Tümör hücrelerinden salınan hormonlara dolaylı olarak paraneoplastik sendromlar gelişebilir. Çeşitli hormonların salınımı sonucunda, salınan hormona bağlı olarak çeşitli bulgular görülebilir. Ayrıca akciğer kanserli hastaların çoğunda kilo kaybı, halsizlik, yorgunluk gibi nonspesifik (özgül olmayan) semptomlar bulunabilir[24][26].
Semptomlar, primer tümörlerin lokalizasyonuna göre değişebilir. Bronş içi (endobronşial) merkezi tümörlerde daha çok öksürük, nefes darlığı, hemoptizi; çevresel olanlarda ise sıklıkla plevra kaynaklı göğüs ağrısı ve dispne gibi semptomlar görülür. Bununla beraber hastaların %5-10'nda hiç semptom olmayabilir[27].
Akciğer kanserine bağlı ortaya çıkan semptomlar primer tümörün yerleşimi ve büyüklüğü, tümörün yayılım yeri ve yayılma derecesi gibi parametrelere göre çeşitlilik gösterebilir. Nefes darlığı genellikle merkezî yerleşimli tümörlerin, bronş içi havayolu tıkanması ile akciğer hacimlerinin azalmasına; göğüs ağrısı ise akciğer çevresi tümörlerde plevra veya göğüs duvarının istilası, brakial pleksusa sızma ve tümöral kitlenin büyümesine bağlıdır. Öksürük merkezî yerleşimli olan tümörlerde çevresel olanlara göre daha sıktır ve havayollarının tıkanması, sıkışması, tümörün içine sızması ve enfeksiyonlarına bağlıdır. Hışırtılı solunum (wheezing) veya stridor hava yolu (trakea veya ana bronş) kısmi tıkanması ile meydana gelir. Ses kısıklığı, özellikle merkezi tümörlerde rekürren larengeal sinir tutulumu ile ilgili; yutma güçlüğü (disfaji) ise, özefagus sıkışması ile ilgili olarak ortaya çıkar. Ayrıca akciğer kanserinde nonspesifik bir bulgu olan ateş; obstrüktif (tıkanmalı) pnömoni ve karaciğer metastazları ile ilgili olup, sıklıkla pürülan (irinli) balgam ve hemoptizi ile birliktedir[22][27].
Görülen belirtiler sıklıkla birincil tümörün sebep olduğu belirtilerdir. Birincil tümöre bağlı belirtilere; göğüs ağrısı, öksürük, dispne, hemoptizi örnek verilebilir. Bununla beraber hastaların %40'ında göğüs kafesi içi (intratorasik) yayılıma bağlı semptomlar görülür. İntratorasik yayılıma bağlı olarak bası yaptığı yerlere göre değişik semptomlara sebep olabilir. Boyundaki sempatik sinirlere bası yaptığında horner sendromu; plevraya doğru yayılım gösterdiğinde plevral efüzyon; özafagusa bası yaptığında özafagiyal belirtiler; superior vena cava tıkanması sonucunda superior vena cava sendromu gibi çeşitli klinik bulgulara neden olabilir. Göğüs kafesi dışı (ekstratorasik) yayılımda ise metastaz yapılan organa göre belirtiler ortaya çıkar. Hastaların yaklaşık 1/3'ünde ekstratorasik yayılıma bağlı belirtiler görülür. Bunlar arasında; kemik ağrısı, kırıklar, akıl bulanıklığı (konfüzyon), kişilik değişmesi, alkalin fosfataz seviyelerinde yükselme, sınırlı konumlu (fokal) nörolojik hasar, baş ağrısı, bulantı, kusma, ele gelen lenfadenopati, zayıflık, halsizlik, bayılmalar gibi belirtiler bulunmaktadır. Yaklaşık %10 hastada ise paraneoplastik sendrom görülür[24].
|
Paraneoplastik sendrom
Paraneoplastik Sendrom, bir tümör veya tümörün metastazları ile doğrudan ilgili olmayan ancak tümörün varlığına bağlı olan ve dolayısı ile tümörün çıkarılmasından sonra gerileyebilen belirtilerdir[27]. Tümör hücrelerinin biyolojik olarak aktif bileşenler salgılaması sonucu meydan gelir. Salgılanan etmenlere (hormon gibi) göre çeşitli belirtilere yol açabilirler. Bunlar arasında; kan sodyum miktarının azlığı (hiponatremi), Cushing sendromu, normalin üstünde kan kalsiyumu (hiperkalsemi), erkek göğüsünde normalden fazla büyüme (jinekomasti) sayılabilir.
Paraneoplastik sendromlar, küçük hücreli akciğer kanserlerinde genellikle daha fazla görülür. Küçük hücreli dışı akciğer kanserlerinde daha sık görülen paraneoplastik sendromlar arasında, hiperkalsemi ve hipertrofik osteoartropati sayılabilir. Hipertrofik osteoartropati, en sık akciğer adenokarsinomlarına eşlik eder.
Fiziki bulgular
İn situ tümör aşamasında fizik bulgu yoktur, tümör büyüdükçe lokal ve genel bulgular ortaya çıkmaktadır. Kronik obstrüktif akciğer hastalığı (KOAH) ile birlikte ise fizik muayenede hışıltılı solunum (wheezing), her iki akciğerde dağınık ronküsler ve ekspiryum uzaması gibi bulgular bulunabilir. Herhangi bir lenf bezini tutacak şekilde tümör yayılmış ise tutulan lenf bezleri muayenede elle hissedilebilir. Lenf bezlerine metastaz oranları; hiler %90, bronşial %40-60, skalen %85, supraklaviküler %15-20 ve hiler-mediastinal %50'dir. Muayenede nadir olarak karina düzeyinde ana bronşların daralmasına ikincil stridor, daha derindeki hava yollarında yerleşmiş tümörlerde ise hışıltılı solunum (wheezing) ve yerelleşmiş ronküs duyulur. Radyolojik tetkiklerde tek taraflı atelektazi, pnömoni ve plörezi görülebilir, fizik muayenede de bu patolojilere bağlı bulgular saptanabilir. Bu bulgular, muayenede göğüsün yarısındaki solunum hareketlerinde kısıtlılık, solunum sırasında göğüsteki titreşimlerde artma veya azalma, perküsyonda tok ses, stetoskopla dinlemede (oskültasyonda) solunum seslerinde azalma ve hırıltı (ral) duyulması gibi bulgulardır. Karaciğer metastazı halinde karaciğer büyümesi (hepatomegali) görülebilir. Serebral yayılım varsa, seyrek olarak vücudun tek tarafında duyu azalması (hemiparezi) veya hareketsizlik hemipleji, veya nöropatiye neden olabilir. Vena cava superior sendromu, Horner sendromu bulguları, çomak parmak ve cilt altında nodüller saptanabilir[22].
Nedenleri
Tütün ürünleri, endüstriyel ürünler (uranyum, radyasyon, asbest), hava kirliliği, beslenme eksiklikleri kanserin oluşmasında rol alan faktörlerdendir. Son araştırmaların ışığında, akciğer kanseri riskini artıran en önemli faktör kanserojen maddelerin uzun süre boyunca solunumundan kaynaklanmaktadır. Akciğer kanserinin oluşumunda şu faktörler yer alır:
|
Sigara
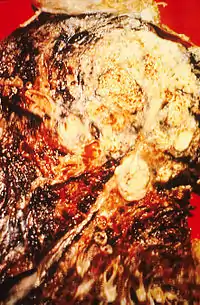
Sigara kullanımı, akciğer kanserinin en sık görülen nedenidir. Bununla beraber akciğer kanseri, sigara içmeyenlerde de görülebilmektedir. Akciğer kanserli erkeklerin %10 ve kadınların ise %20-25'sinde gelişen kanser sigara ile ilişkili değildir[28].
Gelişmiş ülkelerde akciğer kanserinden ölümlerin erkeklerde %92-94'ünün, kadınlarda ise %78-80'inin sigaraya bağlı olduğu bildirilmiştir. Ülkelerin tükettikleri sigara miktarı ile akciğer kanseri ölüm oranı arasında doğrusal bir oran vardır. Bu durum son yıllarda tütün tüketiminin arttığı gelişmekte olan ülkelerde belirgin bir şekilde izlenmektedir. Türkiye'de yapılan çalışmalarda akciğer kanserli kadınların %17'sinin, erkeklerin ise %94'ünün sigara içtikleri bildirilmiştir[22]. Pasif sigara içiciliği (sigara içilen ortamda bulunularak sigara dumanına maruz kalma) de sigara kullanmak gibi akciğer kanseri açısından risk faktörüdür.
Kanser gelişme riski; sigara içme süresi, günde içilen sigara sayısı, erken başlama yaşı, derin çekme (inhalasyon), katran ("tar") miktarı ile artar, kullanımı kesme süresi ile azalır[22][23]. Sigara kullanımı özellikle yılda 20 paketi geçtikten sonra göreceli risk belirgin olarak artış gösterir. Sigara miktarı arttıkça risk katlanarak artmakta ancak sigarayı bıraktıktan sonra risk giderek azalmaktadır. Sigara dışında puro içenlerde risk 3 kat, pipo kullananlarda ise 8 kat artmaktadır. Filtreli ya da düşük katran içeren "light" sigaraları içenlerde kanser riski azalmamaktadır[23]. Sigara ve diğer tütün ürünlerinin kullanım miktarı ve süresi arttıkça akciğer kanseri (ve başka kanserlerin) gelişme ihtimali artmakta, bırakılması durumunda da zamanla azalmaktadır. Akciğer kanseri gelişme riski sigarayı bırakmayı takiben 10-20 yıl içinde hiç içmeyenlerin düzeyine yaklaşmaktadır[22].
Meslek
Belirli meslek (gemi yapımı, yapı malzemeleri çıkarımı, çanak-çömlek imalatı, matbaa işleri, madencilik, vb.) çalışanlarında akciğer kanseri daha sık görülmektedir. Başlıca mesleki karsinojenler arasında; Asbest, arsenik, alüminyum, bis-klorometil eter, krom, hidrokarbonlar (polisiklik aromatik hidrokarbon gibi), hardal gazı, nikel ve nikel bileşenleri, radyasyon, radon, vinil klorid, berilyum, kadmiyum ve formaldehit sayılabilir[22][23].
Sigara dumanı kanser oluşumu sürecinde çevre kirliliği maddeleri ile etkileşmektedir. Bu durum sigara içen uranyum ve asbest işçilerinde çarpıcı bir şekilde izlenir. Öyle ki; akciğer kanseri riski, sigara içen asbest işçilerinde 92 kat, sigara içmeyen asbest işçilerinde sadece 5 kat fazladır[22].
Radon
Radon gazı, Amerika Birleşik Devletleri'nde akciğer kanserinin ikinci en sık (%10) nedenidir ve her yıl 6.000-360.000 akciğer kanserli kişinin ölümünden sorumludur. Radon, kimyasal inert bir gaz olup uranyumun parçalanma ürünüdür. Solukla alındığında radon gazı akciğer epiteli veya diğer hücreleri ile etkileşip kansere neden olur. Toprakta doğal olarak bulunur ve iyi havalandırılmayan ev ve işyerlerinin altındaki topraktaki miktarına bağlı olarak kapalı mekandaki havadaki radon miktarı yüksek olabilir. Üst sınır 4 pCi/L olup 8 pCi/L'nin üstüne çıktığında kanser riski artmaktadır. Sigara ile radonun etkileşimi sinerjiktir ve kanser riski 1,3-1,8 oranındadır. Zemin kat eski binalarda yaşayanlarda sıktır, bu nedenle metro ve tünel işçileri gibi meslekî gruplarda risk taşır[22].
Diğer çevresel faktörler
Akciğer kanseri etyolojisinde rol oynayan önemli karsinojenlerden biri de asbesttir. Gerek endüstriyel olarak gemi, izolasyon, otomotiv sanayi gibi alanlarda kullanımının yanında bu minerale çevresel (tremolit içeren ak toprak ve zeolit) maruziyet de kanser gelişme riskini artırır.[23]
Asbest, akciğer kanseri de dahil olmak üzere çeşitli akciğer hastalıklarına neden olabilir. Asbest maruziyeti ve tütün kullanımı sinerjist etki göstererek akciğer kanseri gelişme riskini artırır[8]. İngiltere'de, asbest akciğer kanserinden ölen erkeklerin %2-3'ünün sorumlusudur[29]. Asbest ayrıca mezotelyoma olarak adlandırılan plevranın kanserine de neden olabilir, mezotelyoma bir akciğer kanseri değildir.
Hava kirliliğinin kanser gelişme riskindeki önemi tartışmalıdır. Bununla birlikte yoğun çevre kirliliği akciğer kanseri mortalite istatistiklerine yansımaktadır. Nitekim kentlerde kırsal kesimde oturanlara göre akciğer kanseri gelişimi 1,3-2,3 kat daha fazladır[22].
Virüsler
Hayvanlarda yapılan çalışmalarda virüslerin akciğer kanserine yol açabildiği gösterilmiştir,[28][30] son yıllarda yapılan çalışmalarda, insanlarda da virüslerin akciğer kanseri için bir risk faktörü olduğu gösterilmiştir. İnsanlarda risk faktörü olduğu ileri sürülen virüsler arasında; İnsan papillomavirüs[31], JC virüs[32], simian virüs 40, BK virüs ve sitomegalovirüs[33] sayılabilir.
Skar gelişimi – Fibrozis
Silisyum maruziyeti ile ortaya çıkan silikozis gibi akciğer hastalıkları ve akciğer dokusunda fibrozis ile seyreden hastalıklar yara izi (skar) dokusunun kanserojen etkisi nedeniyle malignite insidansını arttırır[23]. Sinirli yerleşimli (lokalize) akciğer skar alanlarında ve diffüz (yaygın) akciğer fibrozisi olan hastalarda akciğer kanseri geliştiği bildirilmiştir. Skar yakınında mikroskopik olarak epitelyal dokuda aşırı büyüme (hiperplazi) saptanmıştır. Skar zemininde kanser gelişiminin patogenezi henüz tam olarak bilinmemektedir. Skar ve fibrozis sonucu gelişen damarlaşma eksikliği (avaskülarite) ve dokuda oksijen yetersizliği (anoksi) epitel metaplazisine yol açtığı ve karsinogenezisi hazırladığı düşünülmektedir. Skar alanlarında yüksek akciğer adenokarsinomu insidansı bildirilmiştir. Çalışmalarda akciğer kanserinin sarkoidozlu hastalarda 3 kat fazla geliştiği, tüberkülozlu hastalarda üst loblarda kanserin de birlikte bulunabildiği ve yaklaşık 8 kat fazla görüldüğü, bronşiolo-alveoler tip kanserlerin aileden gelme (konjenital) kistik akciğer hastalığı ile ilişkili olabileceği belirtilmektedir[22].
Beslenme
Birçok epidemiyolojik çalışmada besinle sebze alımının akciğer ve diğer kanser risklerini orta derecede düşürdüğü gösterilmiştir. Bunlari takip eden araştırmalarda retinol veya vitamin A içeren retinoidlerin öncülü (prekürsörü) olan beta karotenin akciğer kanseri riski düşüklüğü ile ilişkili olabileceği öne sürülmüştür. Sigara içenlerde serum beta karoten düzeyleri, içmeyenlerden düşük bulunmuştur. Bu düşüklük, beta karotenlerin diyetle daha düşük alımına ve sigaranın absorbsiyon ve metabolizma üzerindeki etkisine bağlanmıştır. Retinoidlerin birçok çalışmada antikarsinojenik etkileri gösterilmiştir. Ayrıca vitamin A eksikliği solunum sistemi epitelinde, skuamöz metaplaziye neden olmaktadır. Yani normaldeki solunum sistemini döşeyen epitel hücreleri özelliklerini kaybedip yassı (skuamöz) hücrelere dönüşür. Vitamin A fakiri diyetle beslenenlerde, vitamin A zengini beslenenlere kıyasla akciğer kanser riski 4,6 kat daha fazla bulunmuştur. Vitamin C ve selenyum eksikliği, siyah çay ve kolesterol de sorumlu tutulmuştur. Sigara içen erkeklerde 5-8 yıl süre ile vitamin E ve beta karoten verilmesi insidansta azalmaya neden olmamaktadır[22].
Genetik yatkınlık
Akciğer kanserinde kalıtsal ön yatkınlık yaratan faktörlerin varlığı ileri sürülmektedir. Birinci derece akrabalarında akciğer kanseri olan kişilerde kanser geliştirme riski 2-4 kat artmaktadır. Ancak bunun tamamen genetik faktörlere bağlı olmadığı, akrabaların aynı ortamda bulunmasının da etkisi olduğu düşünülmektedir.
Kronik karsinojen maruziyeti sonucunda genetik yapıda hasar oluşmaktadır. Hücreyi kanserleşmeye götüren hasarın temelinde hücre çoğalmasını kontrol eden genlerdeki değişiklik yatar[23].
Aile öyküsünde akciğer kanseri bulunan kadınlarda risk 5-7 kat artmaktadır. Aile öyküsünde akciğer kanseri bulunmasının yanında sigara içme öyküsü de varsa risk 30 kat artmakta, aile öyküsü olmaksızın sadece sigara öyküsü varsa 15 kata kadar artmaktadır[22].
Moleküler genetik ve patogenez
Solunum yolları mukozasının karsinojen etkenlerle uzun süre karşılaşması sonucunda dokularda bir takım değişiklikler olur. Karsinojenler hücre içinde protein, lipid gibi birçok moleküle ve DNA'ya bağlanır. Kronik karsinojen teması ile genetik malzemede hasar oluşur. Bu hasar hücre çoğalmasından sorumlu, c-myc, ras gibi onkogenlerin aktivasyonu ve hücre büyümesini baskılayan Rb, p53 gibi tümör supresör genlerin inaktivasyonuna yol açabilir[22].
Kronik karsinojen maruziyeti sonucunda genetik yapıda hasar oluşmaktadır. Hücre çoğalmasını kontrol eden genlerdeki hasar, kanser oluşumundaki temel unsurdur[23]. Diğer kanser türlerine benzer olarak, akciğer kanserinde de onkogenlerin aktivasyonu ya da tümör baskılayıcı genlerin inaktivasyonu sonucunda gelişir[34]. Son yıllarda proto-onkogen olarak adlandırılan normal ve genellikle hücrenin bölünmesi ile ilgili işlevlerde rol alan genlerin; belirli karsinojenlerle onkogen haline geçerek, karsinogeneziste rol aldıkları anlaşılmıştır[22]. Küçük hücreli karsinomda genellikle c-myc ve Rb; küçük hücreli dışı karsinomda ise genelde ras ve p16'de sorun vardır.
Akciğer kanseri ile ilgili etkinleşmiş onkogenlerin 6 familyası vardır; en önemlileri ras (H-ras, K-ras, N-ras) ve myc (N-myc, C-myc, Lmyc)dir[22]. K-ras proto-onkogenindeki mutasyonlar akciğer adenokarsinomlarının %10-30'undan sorumludur[35][36].
Epidermal büyüme faktörü (EGF) reseptörünü kodlayan ERBB1 geni ve RAS protoonkogenleri daha çok küçük hücreli dışı akciğer kanseri olgularında izlenen mutasyonlardan sorumludur[23]. Epidermal büyüme faktörü reseptörü (EGFR) hücrelerin profilerasyon, apoptoz, anjiogenezis ve tümör invazyonunda rol alır[35].
Tümör supresor genlerin inaktivasyonuna neden olacak kromozomal hasarlar da akciğer kanserinde rol alır. İnsan kanserlerinde en sık bulunan tümör supresör geni kromozom 17'de bulunan p53 ve kromozom 13'teki Rb genidir. Rb, hücre siklusu boyunca ilerlemeyi bloke edip, büyümeyi kontrol eder. p53 mutasyonları büyümeyi hızlandırarak kanser oluşumunda rol oynar. Tüm akciğer kanserli hastaların yarısında bu mutasyonlar gözlemlenmektedir[22]. Baskılayıcı genler içinde en fazla araştırılanı p53 geni mutasyonlarıdır. Bir nükleer fosfoprotein olan p53, özellikle DNA hasarına cevap olarak hücre siklusunu, DNA sentezi ve onarımını, hücre farklılaşmasını ve apoptozisi kontrol eden genleri düzenler[23]. p53 tümör supresör geninin mutasyonları akciğer kanseri vakalarının ise %60-75'inde görülür[37]. 3p, 5q, 13q, ve 17p konumlarında meydana gelen kromozom hasarları, bilhasa küçük hücreli akciğer kanserleri olmak üzere akciğer kanserlerinde görülür[37]. Küçük hücreli akciğer kanseri olgularının %90'ında ve küçük hücreli dışı akciğer kanseri olgularının ise %50'sinden fazlasında, 17p konumunda mutasyonlar bulunmuştur[23].
Tanı
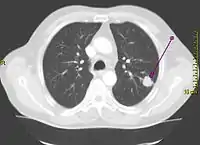
Soliter pulmoner nodül normal akciğer dokusu ile çevrili, herhangi bir adenopati ya da atelektazi ile ilişkisi olmayan bir akciğer radyolojik opasitesidir. Bu opasitenin nedeni, nodül denen, küresel şekilli, nispeten sert, bir hücre kümesine karşılık gelir. En az invaziv (girişimsel) yaklaşımla kötücül nodülleri iyicil nodüllerden ayırmak, doğru ve özgül tanıyı elde etmek soliter pulmoner nodüllü bir hastada temel amaçtır. Soliter pulmoner nodül tanısında ilk adım klinik ve radyolojik değerlendirmedir[38]. Ancak, kanser tanısının kesin olarak konabilmesi için patolojik inceleme yapılması gerekir. Biyopsi sonucu olmaksızın kanser tanısı kesinleşemez. Lenf bezlerine metastaz şüphesi olduğunda lenf bezlerinden biyopsi almak gerekebilir.
Akciğer kanserinin tanısı ve aşamasının saptanması amacıyla, akciğer röntgeni, toraks ve batın BT, Manyetik rezonans görüntüleme, kemik sintigrafisi, beyin BT uygulamalarının yanı sıra bronkoskopi ve mediastinoskopi denilen, lenf bezlerinden biyopsi materyali alınması yöntemleri uygulanır[39].
Akciğer kanserlerine en sık üst loblarda, özellikle de sağ üst lobda rastlanmaktadır[2]. Bronş kanserleri mukozal yerleşebilecekleri gibi mukoza altı lenfatiklerde veya bronş çevresi (peribronşial) alanda bulunabilirler. Mukozada eritem, bronş düzeninin kaybı, bronşlarda daralma, tren rayı gibi mukozal kalınlaşma (mukozanın demiryolu gibi bir hat üzerinde paralel çizgiler şeklinde kalınlaşması), dışarıdan bası ile bronşta düzensizlikler, darlıklar gibi bulgular görülebilir[27].
Akciğer kanserlerine kesin tanı en sık bronkoskopik forseps biyopsilerle konulmaktadır. Son yıllarda gelişen bronş içinden (transbronşiyal) iğne aspirasyon ve deriden (perkütan) biyopsi teknikleriyle hem merkezi (santral) hem de çevre (periferal) tümörlere tanı konulma olasılıkları artmıştır[2]. Forseps biyopsi ile bronş içinde yüzeye doğru büyüyen (ekzofitik) kitlelerde %55-85, bazen ortalama %90 olan tanısal oranlar, submukozal ve peribronşial yayılmalarda %55 gibi daha düşüktür. Bu oranlar bronşial lavaj ve bronşial fırçalama ile birlikte %90'ın üzerindedir. Buna ek olarak; nekrotik tümörlerde büyük ve derin biyopsi alınması, submukozal infiltrasyonlarda transbronşial iğne aspirasyonu ile beraber %97 gibi yüksek tanısal oranlar elde edilir. Submukozal tümörlerde transbronşial forseps biyopsisi ile %55, periferik lezyonlarda %30-50 endoskopik tanı oranları bildirilmiştir[27].
Göğüs radyogramı ve toraks BT tetkikleri ile tümörün lokalizasyonu, büyüklüğü, yayılımı izlenebilir. Bunların yanında, hastanın mevcut olan akciğer hastalıkları (KOAH, amfizem, bronşektazi, atelektazi vs.) ve göğüs duvarındaki yapısal özellikler hakkında bilgi verir[39]. Eşlik eden akciğer hastalıkları hastanın performansının değerlendirilmesi açısından önemlidir.
Temel radyolojik yöntemler arka-ön akciğer grafisi ve toraks BT incelemesidir. Bu incelemeler ile nodüle ait çeşitli özellikler değerlendirilir. Nodül boyutu, kenar özellikleri, iç yapısı, büyüme hızı, stabilite süresi ve lokalizasyonu değerlendirilmesi gereken başlıca özelliklerdir[38].
Pozitron emisyon tomografisi (PET), iyicil ve kötücül soliter akciğer nodüllerinin tanısında yüksek etkinliğe sahip bir yöntemdir. PET'in kötücül nodüller için; duyarlılığı %96,8, özgüllüğü %77,8'dir. İyicil nodüllerdeki duyarlılığı ise %96 ve özgüllüğü %88 olarak bulunmuştur[38].
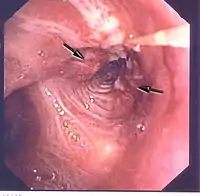
Bronkoskopinin akciğer nodüllerinde tanısındaki değeri, nodülün çapına ve lokalizasyonuna göre değişir. Tanı değeri santral lezyonlarda %82, periferik lezyonlarda ise %53 olarak bulunmuştur[38]. Akciğer tümörlerinde bronkoskopi; tümörün lokalizasyonu, tümörün yaygınlığı, operasyona uygunluğu, histolojik tip tayini, tümörün belirti göstermeyen (asemptomatik) hastada tespiti, tümörün evrelendirilmesi, endobronşial tümör tedavisi gibi önemli rollere sahip bir yöntemdir[27].
Transtorasik iğne aspirasyonunun tanı değeri kötücül lezyonlarda %64-100 arasında olup özgül iyicil tanı oranı %12-68 arasında değişmektedir[38].
Soliter pulmoner nodül tanısında kullanılan cerrahi yöntemler video yardımlı torakoskopik cerrahi (VATS) ve torakotomidir. VATS, morbidite ve mortalitesi düşük, etkinliği yüksek bir yöntem olduğundan düşünülen ilk cerrahi yöntemdir. Yapılan bir araştırmada VATS'ın özgüllüğü %100, morbidite oranı %9,6 ve mortalite oranı %0,5 olarak rapor edilmiştir[38].
Torakotomi yöntemi, hastada radyolojik bulgular ve mevcut risk faktörleri akciğer kanserini düşündürüyor fakat yapılan tetkiklerle kesin tanı konamamış ise tanı koymak amacıyla kullanılabileceği gibi, metastaz taramaları negatif olan hastada rezeksiyon amacıyla da kullanılabilir. Mediastinoskopi, mediastene açılan küçük bir insizyon (kesim) ile bu boşluktan içeri itilen endoskop aracılığı ile soğuk ışık yardımı ile araştırılmasıdır. Akciğer kanserlerinde olguların yaklaşık yarısında mediastinal lenf bezi invazyonu görülebileceğinden mediastinoskopi; trakea, karina, vena kava superior komşuluğundaki lezyonlar ve mediastendeki lenf bezlerinden amaliyat öncesi evreleme amacıyla yapılmaktadır. Mediasten normal ise yapılmayabilir[27].
Evrelendirme
Akciğer kanseri tanısı konduktan sonra, hastanın prognozu hakkında sağlıklı bir yaklaşımda bulunmak, en etkili tedavi yöntemini belirleyebilmek ve alınan tedavi sonuçlarının bilimsel kıyaslamasını yapabilmek için, hastalığın anatomik yaygınlığının saptanması yani evrelendirilmesi gerekir. Akciğer kanseri için birincil tümörün büyüklüğü ve yayımına (T), bölgesel lenf bezi (nodu) tutulumuna (N), uzak metastaz varlığına (M) dayanan TNM evrelendirmesi yapılmıştır. Sonraki yıllarda daha sağlıklı evrelendirme yapabilmek amacıyla TNM sisteminin yeniden geliştirilmesi ile skuamöz, büyük hücreli ve adenokarsinomlu (Küçük hücreli dışı, Non-small cell, NSCLC) hastalar yapılacak tedavi ve prognoz yönünden Evre IA, IB, IIA, IIB, IIIA, IIIB ve IV şeklinde sınıflandırılmaktadır. Küçük hücreli kanserli hastalarda TNM sistemi yerine VALG (Veterans Administration Lung Cancer Group) tarafından önerilen evreleme sistemi kullanılmaktadır. Buna göre hastalığın konumu göğüs kafesinin yarısında (bir hemitoraksta) ise "sınırlı" ve hemitoraksın dışında daha yaygın ise "yaygın" olarak evrelendirilmektedir. Bununla beraber TNM evreleme sistemi küçük hücreli hastalarda da kullanılabilmektedir[27].
Akciğer kanserlerinde evreler:[27]
- Evre 1: Tümör, sadece akciğerin küçük bir bölümünde görülme halidir.
- Evre 1A: Kanser sadece bir akciğerdedir.
- Evre 1B: Kanser ya (a) akciğer içinde büyür, ya (b) akciğerin ana bronşa yayılır ya da (c) akciğeri kaplayan plevranın iç tabakasına yayılır.
- Evre 2: Hastalık, en yakın lenf bezelerine atlamış durumdadır.
- Evre 2A: Kanser, göğüste bulunduğu taraftaki lenf bezlerine yayılır
- Evre 2B:Kanser ya Evre 1B'deki gibidir ve aynı taraftaki lenf bezlerine yayılmıştır; veya kanser lenf bezlerine yayılmamıştır ama şunlardan bir veya daha fazlasına yayılmıştır: (a) Göğüs duvarına (b) Diyaframa, veya (c) akciğerler arasındaki plevraya, (d) kalbin etrafındaki zara ve/veya (e) ana bronşa.
- Evre 3: Tümör, plevra veya iki akciğer arasındaki mediasten denen boşluğa veya buradaki bezelere yayılmışsa bu durum 3. evredir.
- Evre 3A: Kanser kendisiyle aynı taraftaki lenf bezlerine yayılmıştır. Ayrıca şunlardan bir veya daha fazlasına da yayılmış olabilir: (a) Göğüs duvarına (b) Diyaframa, veya (c) akciğerler arasındaki plevraya, (d) kalbin etrafındaki zara (perikardiyum) ve/veya (e) ana bronşa.
- Evre 3B:Kanser köprücük kemiğinin üstündeki lenf bezlerine veya göğsün karşı tarafındaki lenf bezlerine yayılmıştır ve.veya şunlardan biri veya daha fazlasına yayılmıştır: (b) kalbe, (c) aşağı vena kava ve aorta, (d) göğüs duvarına, (e) diyaframa, (f) trakeaya, (g) sternum ve yutağa. Kanser ayrıca plevra tabakaları arasındaki sıvıya da yayılmış olabilir.
- Evre 4: Karaciğer, kemik, böbrek üstü bezi gibi uzak organlara yayılmış durumudur.
Histopatolojik sınıflama
Akciğer kanserlerinin büyük çoğunluğu karsinomdur (epitel hücrelerinden köken alan tümör). Akciğer karsinomlarının iki ana grubu vardır: küçük hücreli dışı (%80,4) ve küçük hücreli (%16,8)[40]. Histolojik kriterleri baz alan bu sınıflama, klinik yaklaşım ve hastalığın prognozu açısından önemlidir. Küçük hücreli dışı akciğer karsinomlarının tek bir grupta toplanmasının nedeni, bu gruptaki karsinom tiplerinin prognozları ve tedavi yaklaşımlarının benzer olmasıdır. Başlıca üç alttipi şunlardır: Skuamöz hücreli karsinom, adenokarsinom ve büyük hücreli karsinom.
| Histolojik sınıf | Sıklık (%) |
|---|---|
| Büyük hücreli | 80.4 |
| Küçük hücreli | 16.8 |
| Karsinoid[41] | 0.8 |
| Sarkoma[42] | 0.1 |
| Sınıflandırılamayan Akciğer kanseri | 1.9 |
Birincil (primer) akciğer kanserinde tümör tipinin bilinmesi tedavi yönteminin seçilmesi ve prognoz açısından önemlidir[43]. Erkeklerde en sık epidermoid kanser (skuamöz hücreli karsinom) görülürken, kadınlarda en sık görülen tümör adenokarsinomdur[2]. Adenokarsinom daha çok çevresel (periferik) yerleşimlidir. Skuamöz hücreli karsinom ise tipik olarak santral bronş yerleşimli olduğu için hilus ve mediasten civarında izlenir. Büyük hücreli karsinom genellikle periferik yerleşimlidir. Küçük hücreli karsinom, proksimal hava yollarındaki yerleşimi ile yine hilus ve mediasten bölgesinde yerleşir ve olguların %78'inde santral yerleşimli radyolojik lezyon ile karşımıza çıkar[25]. Santral tümörler sıklıkla küçük hücreli veya skuamöz hücreli, periferik tümörler ise adenokarsinom veya büyük hücreli tiptedir[27].
| Histolojik alttipler | Küçük hücreli dışı akciğer kanserilerinin sıklığı (%) | ||
|---|---|---|---|
| Sigara içenler | Hiç sigara içmemiş olanlar | ||
| Skuamöz hücreli karsinom | 42 | 33 | |
| Adenokarsinom | Adenokasinom (bronkioalveolar olmayan) | 39 | 35 |
| Bronkioalveolar Karsinom | 4 | 10 | |
| Karsinoid | 7 | 16 | |
| Diğer | 8 | 6 | |
Akciğer kanser tipleri:
- Bronkojenik karsinom %90-95
- Nöroendokrin tümörler %5
- Mezenkimal tümörler %2
- Metastatik tümörler
Bronkojenik karsinom
Bronkojenik karsinom, bronş epitelinden kaynaklanır. Her iki cinste de en ölümcül malignitedir. Erkeklerde daha sık görülmektedir. 4 alt tipi vardır. Bunlar Skuamöz hücreli karsinom, Adenokarsinom, Küçük hücreli karsinom ve Büyük hücreli karsinom 'dur:
- Skuamöz Hücreli Karsinom: Erkeklerde daha sık görülür. Sigara kullanımı ile yakın ilişkilidir (bronşlardaki skuamöz metaplazi zemininden kökenlidir). Büyük boyutta, orta çizgi (santral) yerleşimlidir.Komşu dokulara ilerleme (invazyon) gösterir. Metastaz hızı düşüktür. Büyümüş olan bölgesel lenf düğümlerinde granülomatöz reaksiyon bulguları saptanır. Parathormona benzer bir madde üreterek hiperkalsemiye neden olabilir (paraneoplastik sendrom bulgusu).[45][46]
- Adenokarsinom: Kadınlarda ve sigara içmeyenlerde daha sık görülen tiptir. Daha küçük boyutta ve periferik (plevraya yakın) yerleşimlidir; plevral effüzyona yol açabilir. Tümörün çevresinde kalsifikasyon olabilir. Erken metastaz eğilimi gösterir. Hipertrofik osteoartropati ve tromboflebit gibi paraneoplastik sendrom bulgularına rastlanabilir.[45][46]
- In situ Pulmoner Adenokarsinom (eski adıyla "bronkioalveolar karsinom"): Tümör hücreleri alveolar septayı döşer, temel alveolar yapı korunur. Soliter (tek kitle), nodüler (küçük-yuvarlak oluşumlar) ya da massif infiltrasyon (pnömoniyi anımsatır) olarak saptanabilir.[46] Nadir görülen bir tip olup, daha çok sigara içmeyenler ve kadınlarda görülür[47].
.jpg.webp)
- Küçük Hücreli Karsinom: Santral (hilusa yakın) yerleşim gösterir. Bu grup tümör hücrelerinin çoğu nörosekretuvar granül içerir. Tümör adacıklarında değişik genişlikte nekroz alanları görülür. Bununla beraber kemoterapiye yanıt iyidir. Küçük hücreli akciğer kanseri, daha saldırgan seyirli bir tümör olup, uzak metastaz oranı yüksektir. Bu tümör grubu sıklıkla kemoterapi ve/veya radyoterapi ile tedavi edilir[43]. Onkoterapiye duyarlı olduğu için Tümör lizisi sendromu (hipokalsemi, hiperürisemi, hiperfosfatemi, hiperkalemi) gelişebilir. Cushing sendromu (ACTH etkisi) ile hipertrofik osteoartropati bulgularını içeren paraneoplastik sendrom görülür.[45][46]
- Büyük Hücreli Karsinom: Anaplastiktir. Farklılaşma (diferansiasyon) yoktur. Periperik (plevraya yakın) yerleşim gösterir. Hızla gelişir. Erken metastaz eğilimi gösterir. Jinekomasti (gonadotropin etkisi), hipertrofik osteoartropati gibi paraneoplastik sendrom bulguları görülür.[45][46]
_by_core_needle_biopsy.jpg.webp)
Nöroendokrin tümörler
- Tümörlet: İyicil nöroendokrin tümördür. Endokrin hücrelerin yerleşik (lokalize) çoğalması veya küçük karsinoid kabul edilir.
- Karsinoid Tümör: Santral, periferik, atipik tipleri vardır. Yerel invazyon eğilimi gösterir. Yinelemeler (residivler) sıktır. Pnömotoraks yapabilir. Paraneoplastik sendrom (ACTH, anti-diüretik hormon, parathormon, gonadotropin), tromboflebit ve DIC, sekonder infeksiyonlar ve akciğer absesi gibi komplikasyonları önemlidir. 3–4 cm çapında polipoid oluşumlar bronş lümenine doğru uzanarak büyürler ve akut obstrüktif akciğer hastalığına yol açabilirler.[45][46]
Plevra tümörleri
- Mezotelyoma: Mezotel kökenli plevra tümörüdür. Nedenleri arasında asbestozis çok önemli bir yer tutar.[45][46]
Diğer ve mezenkimal tümörler
Hamartom, inflamatuvar psödotümör, kondrom, lipom, teratom, leyomiyom, endometriozis gibi tümörler örnek verilebilir. Bunlar iyicil tümörlerdir.
Metastatik tümörler
Akciğer, kılcal damar yatağı bol olduğundan sıklıkla metastaz olan bir organdır. En sık meme, gastrointestinal, böbrek tümörleri metastaz yapar. Metastatik tümörler genellikle çoklu, vücudun iki tarafında ve keskin sınırlı olurlar. Çoğunlukla akciğerlerin alt kesimlerinde ve periferik alanlarda (subplevral) yerleşirler. Genellikle 2 mm-10 cm çapında nodüller oluştururlar; bir tümör embolizmi atağı sırasında gelmiş olan tümör hücreleri ayın büyüklükte çok sayıda nodüller oluşturur (2–4 mm çapındaki mikronodüllerin dağılımı Miliar tüberkülozu çağrıştırır). Rektosigmoid kökenli adenokarsinomlar (10 cm çapından büyük nodül), osteosarkom, böbrek karsinomları, testis tümörleri, maligm melanom, meme karsinomları gibi tümörler tek kitle oluşturur (soliter metastaz). Osteosarkom, Kondrosarkom, Sinovyal sarkom metastazlarında kalsifikasyon görülür. Testis tümörü metastazlarında kemoterapi sonrası kalsifikasyonlara rastlanabilir. Koryokarsinom, Angisarkom, Böbrek hücreli karsinom metastazlarında tümör-içi kanamalar oluşur. Osteosarkomlarda pnömotoraks oluşabilir.[46]
- Önce akciğer metastazı yapan tümörler: Koryokarsinom, Malign melanom, Osteosarkom, Testis germ hücreli tümörleri, Böbrek kökenli karsinomlar, Tiroid karsinomları, Hepatosellüler karsinom[46]
- Önce bölgesel lenf düğümü metastazı yapan tümörler: Meme karsinomları, Kolorektal karsinomlar, Yemek borusu (özofagus) ve Mide karsinomları, Prostat karsinomu, Baş-boyun karsinomları[46]
Önleme
Önleme akciğer kanserine karşı savaşın maliyetine oranla en etkili yöntemidir. Çoğu ülkede endüstriyel ve eve ait karsinojenler tespit edilip yasaklanmış olmasına karşın, sigara kullanımı hâlâ yaygındır. Tütün ürünlerinin içilmesinin sona erdirilmesi akciğer kanserine karşı mücadelenin en başta gelen amacıdır, sigarayı bırakma da bu süreçte önemli bir koruyucu önlemdir. Gençleri hedefleyici koruyucu programlar bu girişimlerde özellikle çok önemlidir[48].
Kamusal mekanlarda (lokanta ve işyerleri gibi) pasif sigara içiciliğini azaltmayı amaçlayan politik müdahaleler çoğu Batı ülkelerinde sıkça uygulanır olmuştur. Bu yönde ilk adımı 1998'de kamu alanlarında sigara içimini yasaklayan ABD'de Kaliforniya eyaleti atmıştır, AB ülkeleri arasında da 2004 İrlanda bu yönde ilk herkete geçmiştir. Türkiye'de devlet dairelerinde sigara içimi 1997'de yasaklanmış, 2008'de ise tüm kapalı mekanlarda (bar, kahve ve lokantalar için kanun 2009 Haziran'ından sonra uygulamaya girecek) ve bazı açık mekanlarda (cami ve hastane bahçeleri, stadyumlar) yasaklandı. Butan'da 2005 yılından beri sigara içmek tamamen yasaklanmıştır[49].
Dünya Sağlık Teşkilatı (WHO), gençlerin sigaraya başlamasınının önüne geçmek için tüm ülkelerde sigara reklamlarının yasaklanması için çağrıda bulunmuştur. WHO, bu tür yasaklamaların uygulamaya girdiği yerlerde tütün kullanımının %16 azaldığını belirlemiştir[50].
1998'de ABD'de 46 eyalet, sigara içen kişilere sağladıkları sağlık hizmetlerinin bedelini, dört büyük ABD sigara şirketlerine ödetmek için açtıkları davanın karar aşamasından önce taraflar arasında anlaşmaya varıldı[51]. Anlaşma sonucunda, sigara şirketlerinden şikayetçi olunmayacak ve bu şirketler gelecekte tütün kullanımından kaynaklanan tazminat davalarından muaffiyet elde edeceklerdir. Buna karşın sigara şirketleri pazarlama etkinliklerini sınırlamayı kabul ettiler ve bu 46 eyalete yıllık bir ödeme yapmayı kabul ettiler. ABD Hastalık Kontrol ve Korunma Merkezleri (Centers for Disease Control and Prevention, CDC) toplanan bu fonların %15'inin sigara içimiyle ilişkili hastalıklara karşı koruyucu sağlık harcamalarına ayrılmasını önermişse de, çoğu eyalet bu oranın çok altında para harcamaktadır[51].
Tedavi
Klinik ve tedavi açısından, birincil akciğer kanserleri, küçük hücreli akciğer kanseri (KHAK) ve küçük hücreli dışı akciğer kanseri (KHDAK) olmak üzere ikiye ayrılmaktadır. Akciğer kanserinin hücre tipinin belirlenmesi, tedavi planlanması ve prognozu açısından önem taşımaktadır[52].
Akciğer kanserinde erken dönemde hastalıkta cerrahi tedavi ile uzun süreli yaşam %85 gibi yüksek oranlara varmaktadır. Türk Toraks Derneği'nin yapmış olduğu çok merkezli çalışmada akciğer kanserli hastaların %85'i tanı anında evre III ve IV olarak bulunmuştur. Akciğer kanserinden ölümlerin nedeni çoğunlukla uzak metastazlardır. Bu nedenle erken tanı büyük öneme haizdir[27].
Hastalığın evresi ve histolojik tipini belirledikten sonra, hastanın yaşı ve performans durumu da göz önünde tutularak tedavisi planlanmaktadır[53].
Genel kural olarak; tüm hastalıkların tedavide yarar/zarar oranı yapılmakta ve buna göre karar verilmektedir. Kanser tedavisinde radyoterapi, kemoterapi ve cerrahi yöntemler uygulanabilmektedir. Kanser tedavisinde de uygulanan tedavi yöntemlerine göre çeşitli yan etkiler görülmekle birlikte bu genel kural göz önüne alınmaktadır. Kanser tadavisinde çeşitli yan etkiler görülebilmektedir. Bununla beraber bu etkiler çeşitli faktörlerden etkilenmektedir. Bunlar arasında; uygulan tedavi yöntemine, tedavide uygulanan kemoterapötik ajana, kemoterapi ve/veya radyoterapinin dozu sayılabilir. Her çeşit yan etki bütün hastalarda görülmeyeceği gibi, bazı yan etkileri hasta kendisi fark edemeyebilir. Bu nedenle çeşitli tetkikler ile ortaya çıkabilecek yan etkilere karşı önlem alınmaya çalışılır.
Küçük hücreli dışı akciğer kanseri tedavisi
Küçük hücreli dışı akciğer kanserinde, metastatik hastalık saptanmayan olguların büyük çoğunluğunda cerrahi tedaviyle şifa (kür) şansı sağlanmaktadır. KHDAK'lıların altgrupları arasında da, prognoz ve yayılımları açısından farklılıklar vardır. Epidermoid kanserlerin adenokanserlerden daha iyi prognoza sahip olduğu bildirilmiştir. Adenokanser ve büyük hücreli kanserler, epidermoid kanserlere göre daha sık beyin metastazı yapar. Bu nedenle, birçok araştırmacı da adenokanser ve büyük hücreli kanserler için ameliyat öncesi sistemik taramanın rutin olarak yapılmasını önermektedir[52]
Hastalığın ilk evrelerinde (evre 1, evre 2 ve kimi evre 3 durumlarda) cerrahi müdahale uygulanarak tümörlü doku temizlenir. Bu uygulama, tüm bir akciğer lobunun alınmasına kadar gidebilir. Ameliyat sonrası kontroller sonucunda ender olarak radyoterapiye gereksinim duyulduğu görülmektedir. 3. evre kanser tanılarında ameliyatla yokedilme olanağı bulunmayan tümörler için radyoterapi (ışın tedavisi) ya da kemoterapi (ilaç tedavisi) öngörülür. Bu yöntemler sırayla ve hekim denetiminde uygulanır. 4. Evre akciğer kanserinde kemoterapi, yaşam süresini üç ila altı ay kadar uzatmaktadır. Bu durumda kemoterapinin yan etkileri nedeniyle hasta-aile-hekim kararına gerek duyulur.
Küçük hücreli akciğer kanseri tedavisi
En saldırgan seyirli akciğer kanseri tipi olan küçük hücreli akciğer kanserinde, tedavi seçeneği olarak çoğunlukla kemoterapi kombinasyonları tercih edilmektedir. Hastalık çok sınırlı (evre I) ise cerrahi tedavi uygulanabilmektedir. Vakaların büyük çoğunluğunda kemoterapiye yanıt iyidir. Bu sayede sağkalım süresi uzatılmasına karşın, şifa şansı oldukça düşüktür[52].
Bu türün tedavisinde hastalığın yayılma aşaması, verilecek kararı etkiler. Az yayılma durumunda kemoterapinin ardından radyoterapi uygulanır. Beyne yayılmasının yüksek olasılık içermesinden dolayı, beyne de radyoterapi yapılır. Ender olarak küçük cerrahi müdahaleler gerekebilir. Tümörün yayılmış hallerinde ise kemoterapi uygulanmasına karşın, tekrarlama riskinin yüksek olmasından dolayı radyoterapi yapılabilir.
Tedavi yöntemleri
Akciğer kanserinin tedavisinde uygulanacak prosedüre karar verilirken; kanserin histopatolojik tipi, mevcut evresi ve hastanın performans durumu göz önüne alınmaktadır. Sıklıkla uygulanan tedavi yöntemleri; cerrahi, kemoterapi ve radyoterapidir[13][54].
Cerrahi
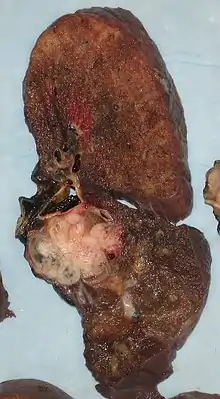
Yapılan tetkiklerle akciğer kanseri tanısı doğrulanmışsa; bilgisayarlı tomografi ve sıklıkla pozitron emisyon tomografisi kullanılarak kanserin yerleşimine ve cerrahiye uygun olup olmadığına veya cerrahi ile tedavi edilemeyecek yerlere yayılıp yayılmadığına karar vermek amacıyla kullanılır.
Hastaların ameliyata uygun olup olmadığına karar vermek amacıyla ek olarak, kan testleri ve spirometri (akciğer fonksiyon testi) de gerekli olan tetkiklerdir. Spirometride solunum kapasitesi az bulunursa (sıklıkla KOAH nedenli) cerrahi önerilmez. Hastanın akciğer fonksiyonu ve diğer risk faktörlerine bağlı artıp azalmak üzere, cerrahi uygulamalarda ölüm riski yaklaşık %4,4'dür[55].
Evre IIIA'ya kadar, tek akciğerde yerleşik küçük hücreli dışı akciğer kanserlerinde sıklıkla cerrahi tercih edilmektedir. Akciğer dokusu alındıktan sonra akciğer fonksiyonlarında sorun olmamasını sağlamak için, ameliyat öncesinde solunum kapasitesi yeterli olmalıdır.
Cerrahi yöntemler şunlardır; dilim (wedge) rezeksiyon (bir akciğer lobunun bir parçasını çıkarma), segmentektomi (akciğerin loblarının anatomik parçaları olan segmentlerden birinin çıkarılması), lobektomi (bir lobun çıkarılması), bilobektomi (iki lobun çıkarılması) veya pnömonektomi (bir akciğerin tamamen çıkarılması).
Yeterli solunum kapasitesi olan hastalarda, lobektomi tercih edilebilir, bu prosedür aynı yerde kanserin tekrarlama olasılığını azaltmaktadır. Solunum fonksiyonu yeterli olmayan hastalarda, wedge rezeksiyon uygulanabilir[56]. Yapılan bir çalışmada, ameliyat sırasında brakiterapi uygulamasının kanserin aynı yerde tekrarlama olasılığını azalttığı gösterilmiştir[57].
Akciğer kanseri ameliyatları açık veya kapalı yöntemle gerçekleştirilir. Amerikan Göğüs Hastalıkları Birliği (ACCP) hastalarda daha az zarar verici ve daha başarılı sonuçları olması sebebiyle akciğer kanseri ameliyatlarında torakoskopi veya VATS denilen kapalı yönteminin tercih edilmesi gerektiğini savunmaktadır[58]. Tek Port Torakoskopi (VATS) yönteminde 3,5–5 cm arası tek bir kesi yapılarak göğüs boşluğuna ilerletilen bir kamera ile alınan görüntülere göre kanserli akciğer dokusu ve lenf bezleri çıkartılmaktadır[59].
Kemoterapi
Küçük hücreli akciğer kanseri tedavisinde ilk seçenek kemoterapi ve radyoterapidir. Bu hastalarda cerrahinin hayatta kalma süresine etkisi olduğu gösterilememiştir. Buna ek olarak, kemoterapi metastatik küçük hücreli olmayan akciğer kanserlerinde de ilk terchtir.
Kemoterapide uygulanacak ajanlara, histopatolojik sınıflamaya göre karar verilir. Küçük hücreli dışı akciğer kanserinde sıklıkla; sisplatin veya karboplatin ve buna ek olarak gemsitabin, paklitaksel, doketaksel, etoposide veya vinoelbine adlı kemoterapötiklerden biri kullanılır[60]. Küçük hücreli akciğer kanserinde, sisplatin ve etoposide en sık kullanılan kombinasyondur[61]. Bununla beraber, sisplatin ile kombinasyon amacıyla şu ajanlar da kullanılabilir; karboplatin, gemcitabine, paclitaxel, vinorelbine, topotecan ve irinotecan[62].
KHDAK'de adjuvan kemoterapi
Yardımcı (adjuvan) kemoterapi, ameliyat sonrasında uygulanan kemoterapidir. Ameliyat sırasında, lenf nodlarından örnek alınır, şayet örneklerde kanser tespit edilirse hasta evre II veya evre III'dedir. Bu durumda, adjuvan kemoterapi uygulaması, hayatta kalma oranını %15 artırmaktadır[63][64]. Adjuvan kemoterapide platinum ajanları (sisplatin veya karboplatin gibi) tercih edilir[65]. Evre IB kanser tanısı amış hastalarda, adjuvan kemoterapi uygulaması tartışmalıdır. Şimdiye kadar yapılan klinik araştırmalarda hayatta kalma süresine katkısı net olarak gösterilememiştir[66][67]. Rezeksiyon yapılmaya uygun küçük hücreli dışı akciğer kanserlerinde, preoperatif kemotrapi uygulaması (neoadjuvan kemoterapi) tesirsizdir[68].
Radyoterapi
Radyoterapi; genellikle kemoterapinin yanında verilir ve küçük hücreli dışı akciğer kanseri olan ancak cerrahiye uygun olmayan hastalarda iyileştirme amaçlı kullanılabilir. İyileştirici amaçlı kullanılan radyoterapi yüksek dozda uygulanır, bu uygulama radikal radyoterapi olarak adlandırılır. Bu tekniğin gelişmiş şekli devamlı hiperfraksiyone hızlandırılmış radyoterapi (CHART) tekniğinde, yüksek dozda radyoterapinin kısa zaman aralığında verilmektedir[69]. Küçük hücreli akciğer kanseri vakaları için iyileştirici potansiyeli vardır, kemoterapiye ek olarak göğüse radyoterapi uygulanması sıklıkla önerilen bir uygulamadır[70]. Küçük hücreli akciğer kanserinde, iyileştirme amaçlı cerrahi sonrası yardımcı (adjuvan) torasik radyoterapi uygulamasının yararı kesin olarak kanıtlanamamıştır ve dolayısıyla tartışmalıdır. Yararları, sadece mediastinal lenf nodlarına yayılan tümörlerle sınırlı olabilir[71][72].
Hem küçük hücreli hem de küçük hücreli olmayan akciğer kanseri hastaları için; göğüse küçük dozlarda radyoterapi uygulaması belirtilerin kontrolünde işe yarayabilir, bu uygulamaya palyatif radyoterapi adı verilir. Diğer tedavilerden farklı olarak, akciğer kanseri tanısı histolojik olarak onaylanmadan palyatif radyoterapi uygulanabilir.
Eğer kanser bronkusun kısa bir kısmını etkilediyse, brakiterapi direkt havayolu içine uygulanabilir[73]. Ayrıca ameliyat edilemeyen akciğer kanseri büyük havayollarının tıkanmasına sebep olduğunda uygulanabilir[74].
Erken evre küçük hücreli akciğer kanserinde genellikle profilaktik kraniyal radyasyon (İng. profilactic cranial radiation; PCI) uygulanır. Bu yöntem beyne uygulanan radyoterapi yöntemlerinden biridir, metastaz riskini azaltmak amacıyla kullanılır[75]. Son yıllarda, PCI uygulamasının yaygın küçük hücreli akciğer kanserlerinde de yarar sağladığı gösterilmiştir. Kanserli hastalarda kemoterapi tedavisini takiben PCI uygulamasının bir yıl içinde beyin metastazı olma riskini %40,4 ila %14,6 oranında azalttığı gösterilmiştir[76].
Erken evre akciğer kanseri tedavisinde stereotaktik radyoterapi uygulaması da mümkündür. Radyoterapinin bu çeşidinde, art arda farklı yönlerden verilen radyasyon ışınları tümörün bulunduğu noktada kesişirler, böylece sağlıklı dokulara olan zarar en azda tutulur, tümörde yüksek miktarda radyasyon dozu birikir. Bu tedavi yöntemi, kansere ek olarak başka hastalıkları nedeniyle cerrahiye uygun olmayan hastalarda ilk tercih edilen yöntemdir[77].
Ablasyon
Radyofrekans ablasyon (RFA) yöntemi, küçük boyuttaki birincil tümörler veya sınırlı yayılım gösteren metastazlar için, ameliyat mümkün değilse kullanılabilen bir alternatiftir.[78] Bu yöntem, küçük bir sondanın tümör içine sokularak tümör hücrelerine mikrodalga vererek ısıtma yoluyla öldürülmesi şeklinde uygulanır.[79] Mikrodalga ablasyon (MWA) yöntemi aynı sonucu elde eden, mikrodalgayla çalışan daha yeni bir yöntemdir. Özellikle merkezi tümörlerde daha iyi sonuç verdiği düşünüldüğünden radyofrekans ablasyon tekniğinin yerini almaya başlamıştır.[78]
Hedefe yönelik kanser tedavisi
Akciğer tümörlerinin moleküler düzeydeki belli başlı değişiklikler için test edilebilmesi, çeşitli moleküler düzeyde hedefe yönelik kanser tedavi yöntemlerini mümkün kılmıştır. Adenokarsinom tipi küçük hücreli dışı akciğer kanseri hastalarının, Asya-Pasifik bölgesinde %48, Avrupa ve Amerika'da %19'unda epidermal büyüme faktörü reseptörünün (EGFR) kansere yol açan mutasyonu görülür.[80] Bu nedenle epidermal büyüme faktörü reseptöründe bulunan tirozin kinazı hedefleyen ilaçlar (gefitinib ve erlotinib) geliştirilmiştir. Bu ilaçlar, EGFR mutasyonu için test sonucu pozitif çıkan hastalara verilir;[81] özellikle sigara içmemiş hastalar, kadın hastalar ve Asya asıllı hastalarda daha etkili olan ilaçlarda bu sonucun pozitif olma olasılığı daha yüksektir.[47] Gefitinib tipi ilaçlarla, metastatik küçük hücreli dışı akciğer kanserli hastalarda sağkalım süresinde yarar sağlandığı günümüzde bilinmektedir[82].
EGFR mutasyonu dışındaki durumlarda kullanılabilecek hedefe yönelik tedaviler de geliştirilmiştir. ALK ve ROS1 genlerinde değişiklik saptandığı takdirde crizotinib kullanılır.[81] BRAF inhibitörü dabrafenibin, direnç oluşmaması için MEK inhibitörü trametinib ile beraber kullanımı, BRAF V600 mutasyonu saptanan hastalar için 2017 yılında Avrupa Birliği'nde onaylandı.[83]
Anjiogenez inhibitörü olan bevacizumabın (platin bazlı kemoterapi ile birlikte kullanılır), ileri evre küçük hücreli dışı akciğer kanseri hastalarında sağkalım sürelerini uzattığı gösterilmiştir.[84] Bununla beraber, -özellikle squamöz hücreli karsinom hastalarında- akciğerde kanama riski artar.
Sitotoksik ilaçlar[85], farmakogenetik[86], ve hedefe yönelik ilaçlardaki[87] ilerlemeler umut vadetmektedir. Hedefe yönelik ilaçların çoğu klinik araştırma safhasına ulaşmış olsa da henüz klinik araştırmaların erken safhalarındadır. Bunlardan bazıları; siklo-oksijenaz-2 (COX-2) inhibitörleri[88], apoptozisi tetikleyen ilaçlar[89], proteazom inhibitörleri[90], beksaroten[91] ve aşılardır[92]. Diğer araştırma alanları şunlardır; ras proto-onkogen inhibisyonu, fosfoinozitid 3-kinaz inhibisyonu, tümör baskılayıcı genleri yerine koyma ve histon deasetilaz inhibisyonu[93].
Gidiş ve sonlanış
Küçük hücreli olmayan akciğer kanseri için prognostik faktörler şunlardır: pulmoner semptomların varlığı ya da yokluğu, tümör büyüklüğü, histolojik tipi (hücre tipi), evresi (yayılım derecesi) ve lenf bezlerine metastaz, damarların tümörü istilası (vasküler invazyon). Cerrahi uygulanmayan hastalarda, %10'dan daha fazla kilo kaybı ve performans durumunun kötü olması prognozu kötü etkiler[94]. Küçük hücreli akciğer kanserinde prognostik faktörler ise şunlardır: performans durumu, cinsiyet, hastalığın evresi, hasta tanı aldığında merkezî sinir sistemi veya karaciğere yayılım olup olmaması[95].
Küçük hücreli dışı kanserlerin prognozu genellikle kötüdür. Evre IA safhasındaki hastalığın tam cerrahi rezaksiyonu takiben 5-yıllık yaşam %67'dir; evre IB olan hasta için ise 5-yıllık yaşam %57'ye düşer[96]. Evre IV küçük hücreli olmayan akciğer kanseri hastasında 5-yıllık sağkalım oranı yaklaşık %1'dir [3].
Küçük hücreli akciğer kanserinin de prognozu kötüdür. Tüm evreler göz önüne alındığında 5-yıllık yaşam oranı ortalama %5 civarındadır[13]. İleri evredeki küçük hücreli akciğer kanserilerinde 5-yıllık yaşam oranı %1'den azdır. Ortalama sağkalım zamanı çok ilerlememiş evrelerde 20 ay olup 5-yıllık sağkalım ise %20'dir[3].
Amerikan Ulusal Kanser Enstitüsü (National Cancer Institute) verilerine göre, akciğer kanseri ortalama tanı alma yaşı 70, ölüm yaşı ise 71'dir[97].
Küçük hücreli akciğer kanseri, daha saldırgan seyirli bir tümör olup, uzak metastaz oranı daha yüksektir. Bununla beraber kemoterapiye yanıt iyidir.[43]. KHDAK'lılarda ise metastatik hastalık saptanmayan olguların büyük çoğunluğunda cerrahi tedaviyle iyileşme şansı sağlanmaktadır. KHDAK'lıların altgrupları arasında da, prognoz ve yayılımları açısından farklılıklar vardır. Epidermoid kanserlerin adenokanserlerden daha iyi prognoza sahip olduğu bildirilmiştir. Adenokanser ve büyük hücreli kanserler, epidermoid kanserlere göre daha sık beyin metastazı yapar[52].
Akciğer Kanserlerinde Paraneoplastik Sendrom[45][46]
- Hormon gibi etki gösteren peptidlerin üretimi (ADH, ACTH, parathormon, gonadotropin)
- Osteoporoz (ACTH etkisi)
- Hiponatremi (ADH etkisi)
- Hiperkalsemi (parathormon etkisi)
- Jinekomasti (gonadotropin etkisi)
- Eaton-Lambert sendromu: periferik nöropati + myasthenia olgusunu anımsatan bulgular
- Deride Acanthosis nigricans
- Hipertrofik osteoartropati bulguları
- Santral Sinir Sistemi etkilenmesi: serebellar dejenerasyon, limbik ensefalopati)
Tarihçe
1930'lara kadar pek sık görülmeyen primer akciğer kanseri, zaman içinde en sık görülen kanser türlerinde başlarda yer almaya başlamıştır. ABD'de 1920'de 956 akciğer kanseri vakası bildirilmişken, 1950 yılına gelindiğinde artık önemli bir halk sağlığı sorunu olarak kabul edilmeye başlanmıştır[99]. Günümüzde her iki cinsiyette de kanserden ölümlerinin başında yer almaktadır. Akciğer kanseri 1930'lu yıllarda genellikle erkeklerde görülen bir kanser türü iken; 1960'larda kadınlarda görülme sıklığı artmaya başlamış, hâlen de bu artışını sürdürmektedir. 1980'li yıllarda sigara karşıtı kampanyaların başlamasıyla -bilhassa gelişmiş ülkelerde- akciğer kanseri insidansında azalma olmuştur. Özellikle genç nesilde sigara kullanımının az olması sayesinde ABD'de 1980'lerde erkeklerde 87/100.000 olan insidans, 1991'de 80/100.000'e düşmüştür[99]. Ancak gelişmekte olan birçok ülkelerde her yaş grubunda akciğer kanseri oranı artmaya devam etmektedir. Dünyada 1975-1990 yılları arasında akciğer kanseri vakalarında ölüm oranı erkeklerde %66, kadınlarda %110 artmıştır[100]. Batı Avrupa, Kuzey Amerika, Avustralya ve Yeni Zelanda'da erkeklerde kanser insidansı 1980'lerde doruğa ulaşmış ve o zamandan ber azalmaktadır. Buna karşın Doğu ve Güney Avrupa ülkelerinde, Japonya ve Çin'de ve çoğu gelişmiş ülkedeki kadınlarda insidans artmakta veya daha yeni yavaşlamaktadır. Gelişmekte olan ülkelere ait veriler seyrek olmakla beraber; Asya, Afrika ve Latin Amerika ülkelerinde artmaya devam etmesi beklenmektedir[101].
Sigara içiciliğinin yaygınlaşmasından önce oldukça nadir görülen bir hastalık olan akciğer kanseri; 1761 yılına kadar doğru dürüst tanınan bir hastalık dahi değildir[102]. 1810'larda akciğer kanseri ile ilgili değişik görüşler ortaya atılmaya başlanmıştır[103]. 1878 yılında otopsi materyallerinde yapılan bir çalışmada, tüm kanser türleri içinde kötücül (malign) akciğer kanseri vakaların sadece %1'ini oluşturmuş, fakat 1900'lerin başında %10-15'lere yükselmiştir[104]. 1912 yılında dünya çapında tıbbi literatüre geçen sadece 374 vaka vardır[105][106]. Otopsi raporlarının derlenmesi yoluyla yapılan bir gözden geçirmede akciğer kanseri insidansı 1852'de %0,3 iken, 1952'de %5,66'e yükseldiği gösterilmiştir[107]. 1929 yılında Almanya'da Fritz Lickint adındaki bir hekim, akciğer kanseri ve sigara arasında bir ilişki olduğunu ilk kez öne sürmüştür[104]. 1950'lerde yayınlanan İngiliz doktorların bir çalışması ile, akciğer kanseri ve sigara arasındaki ilişki ilk kez epidemiyolojik verilerle kanıtlanmıştır[108]. Bunların sonucunda 1964 yılında Birleşik Devletler Askeri Başhekimi (Surgeon General of the United States) tarafından sigara içicilerine sigarayı bırakmaları gerektiği önerilmiştir[109].
1470 yılından beri gümüş madenleri bulunan, Schneeberg, Saxonya yakınlarındaki Ore Dağları'ndaki madenlerin çevresinde ilk kez radon gazı ile akciğer kanseri arasındaki ilişki fark edilmiştir. Buradaki madenler uranyum açısından zengin olmakla beraber radyum ve radon da ihtiva etmektedir. Burada çalışan madencilerin yüksek oranda akciğer kanserine yakalanmaları sonucunda, 1870'lerde akciğer kanseri ile ilişki tanımlanmıştır. Emekli maden çalışanlarından %75'i akciğer kanserinden ölmüştür[110]. Bu bilgiye rağmen, Sovyetler Birliği'nin uranyum isteği nedeniyle, 1950'lere kadar bu maden çalışmaya devam etmiştir[111].
Akciğer kanseri için ilk başarılı pnömonektomi 1933[112] yılında gerçekleştirilmiştir, ve pnömonektomi cerrahi tedavi seçeneği olarak kullanılmaya başlanmıştır[113]. Bununla beraber kanser evrelendirmesi ve cerrahi tekniklerdeki gelişmelerle, lenf nodu diseksiyonu ile beraber lobektomi bugün için daha iyi bir tedavi seçeneğidir[114][115].
Palyatif radyoterapi, 1940'lardan beri kullanılmaktadır[113]. Radikal radyoterapi ise 1950'lerden beri kullanılmaktadır. Radikal radyoterapide daha yüksek radyasyon dozları kullanılmakla beraber, bu tedavi göreceli olarak daha erken evredeki ve cerrahi için uygun olmayan hastalarda kullanılan bir tedavi yöntemidir[116]. 1997 yılında, geleneksel radikal radyoterapi yerine CHART (continuous hyperfractionated accelerated radiotherapy) adında yeni bir yöntem geliştirilmiştir[69]. Bu yöntemde bir günde verilecek toplam radyasyon günde üç doz olarak bölüştürülür.
Küçük hücreli akciğer kanserli hastalarda, 1960'larda denenen cerrahi rezeksiyon[117] ve radikal radyoterapi[118] başarısız olmuştur. 1970'lerde başarılı kemoterapi rejimleri geliştirilmesiyle tedavi şansları artmıştır[119].
Ayrıca bakınız
Dış bağlantılar
| Wikimedia Commons'ta Lung cancers ile ilgili ortam dosyaları bulunmaktadır. |
Kaynakça
- "Lung Cancer Estimated Incidence, Mortality and Prevalence Worldwide in 2012". Dünya Sağlık Örgütü. 28 Ağustos 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ağustos 2017.
- Köktürk N, Yeğin D, Ulukavak Çiftçi T, Bilgin Mullaoğlu S, Öztürk C. Akciğer Kanserlerinde Epidemiyolojik Özellikler Yıllar İçinde Değişim Gösteriyor mu? Türk toraks dergisi, Aralık 2004, Cilt 5, Sayı 3, Sayfa(lar) 137-142. Tam metin 9 Kasım 2005 tarihinde Wayback Machine sitesinde arşivlendi.
- The Merck Manuals. Lung Carcinoma: Tumors of the Lungs Merck Manual Professional Edition, Online edition. Tam metin 16 Ağustos 2007 tarihinde Wayback Machine sitesinde arşivlendi. Erişim tarihi 2007-08-15.
- Thun MJ, Hannan LM, Adams-Campbell LL, Boffetta P, Buring JE, Feskanich D, Flanders WD, Jee SH, Katanoda K, Kolonel LN, Lee IM, Marugame T, Palmer JR, Riboli E, Sobue T, Avila-Tang E, Wilkens LR, Samet JM. Lung Cancer Occurrence in Never-Smokers: An Analysis of 13 Cohorts and 22 Cancer Registry Studies. PLoS Med. 2008 Sep 9;5(9):e185. PMID 18788891 6 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Gorlova OY, Weng SF, Zhang Y, Amos CI, Spitz MR. Aggregation of cancer among relatives of never-smoking lung cancer patients. Int J Cancer. 2007 Jul 1;121(1):111-8. PMID 17304511 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Hackshaw AK, Law MR, Wald NJ. The accumulated evidence on lung cancer and environmental tobacco smoke. BMJ. 1997 Oct 18;315(7114):980-8. PMID 9365295 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Catelinois O, Rogel A, Laurier D, Billon S, Hemon D, Verger P, Tirmarche M. Lung cancer attributable to indoor radon exposure in france: impact of the risk models and uncertainty analysis. Environ Health Perspect. 2006 Sep;114(9):1361-6. PMID 16966089 1 Mayıs 2011 tarihinde Wayback Machine sitesinde arşivlendi.
- O'Reilly KM, Mclaughlin AM, Beckett WS, Sime PJ. Asbestos-related lung disease. Am Fam Physician. 2007 Mar 1;75(5):683-8. PMID 17375514 1 Ağustos 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Kabir Z, Bennett K, Clancy L. Lung cancer and urban air-pollution in Dublin: a temporal association? Ir Med J. 2007 Feb;100(2):367-9. PMID 17432813 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Coyle YM, Minahjuddin AT, Hynan LS, Minna JD. An ecological study of the association of metal air pollutants with lung cancer incidence in Texas. J Thorac Oncol. 2006 Sep;1(7):654-61. PMID 17409932 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Chiu HF, Cheng MH, Tsai SS, Wu TN, Kuo HW, Yang CY. Outdoor air pollution and female lung cancer in Taiwan. Inhal Toxicol. 2006 Dec;18(13):1025-31. PMID 16966302 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Köktürk N, Ulukavak Çiftçi T, Yeğin D, Bilgin Mullaoğlu S, Habeşoğlu MA, Öztürk C. Akciğer Kanserli Olgularımızda Semptomatolojik, Radyolojik ve Endoskopik Bulguların Histopatolojik Bulgularla Birlikte Değerlendirilmesi. Türk toraks dergisi, Aralık 2004, Cilt 5, Sayı 3, Sayfa(lar) 143-147. Tam metin
- Minna JD (2004). Harrison's Principles of Internal Medicine. McGraw-Hill, 506–516. ISBN 0-07-139140-1.
- Vaporciyan AA, Nesbitt JC, Lee JS ve ark. (2000). Cancer Medicine. B C Decker. s. 1227–1292. ISBN 1-55009-113-1
- Bozkurt B, Selçuk ZT, Fırat P, Kalyoncu AF, Artvinli M. 1972-2002 Döneminde Hacettepe Üniversitesi Tıp Fakültesi Hastanesi’nde Akciğer Kanseri Tanısı Konulan Hastaların Histolojik ve Epidemiyolojik Değerlendirmesi. Türk toraks dergisi Aralık 2004, Cilt 5, Sayı 3, Sayfa(lar) 148-153. Tam metin 23 Aralık 2005 tarihinde Wayback Machine sitesinde arşivlendi.
- "Surveillance, Epidemiology and End Results Program". National Cancer Institute. 21 Ağustos 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ağustos 2017.
- Majumder, edited by Sadhan (2009). Stem cells and cancer (Online-Ausg. bas.). New York: Springer. s. 193. ISBN 978-0-387-89611-3. 2 Mayıs 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ağustos 2017.
- World Health Organization. (2004) The World Health Report Tam metin 25 Ağustos 2011 tarihinde WebCite sitesinde arşivlendi
- Jemal A, Tiwari RC, Murray T, Ghafoor A, Samuels A, Ward E, Feuer EJ, Thun MJ; American Cancer Society. Cancer statistics, 2004. CA Cancer J Clin. 2004 Jan-Feb;54(1):8-29. PMID 14974761 25 Kasım 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- "National Lung Cancer Partnership: Lung Cancer in American Women". 9 Temmuz 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Ocak 2007.
- "20-year Lag Time Between Smoking and Lung Cancer". U.S. National Cance Institute - Science Behind the News. 17 Şubat 2003 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Şubat 2003.
- Akkoçlu, Atilla. Akciğer kanserleri. Türk Toraks Derneği. Tam metin
- Göksel, Tuncay. Akciğer kanseri. Türk Toraks Derneği yayınları. Tam metin
- Collins LG, Haines C, Perkel R, Enck RE. Lung cancer: diagnosis and management. Am Fam Physician. 2007 Jan 1;75(1):56-63. PMID 17225705 25 Kasım 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- Savaş İ, Kaya A. Akciğer Kanserlerinde Semptomlar ve Bulgular. Türkiye Klinikleri J Surg Med Sci 2006, 2(12):66-71.
- Akkoçlu, Atilla. Akciğer kanserlerinde tanı, evreleme ve tedavi öncesi değerlendirme. Türk Toraks Derneği. Tam metin 7 Mart 2010 tarihinde Wayback Machine sitesinde arşivlendi.
- Palmarini M, Fan H. Retrovirus-induced ovine pulmonary adenocarcinoma, an animal model for lung cancer. J Natl Cancer Inst. 2001 Nov 7;93(21):1603-14. PMID 11698564 13 Ağustos 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Darnton AJ, McElvenny DM, Hodgson JT. Estimating the number of asbestos-related lung cancer deaths in Great Britain from 1980 to 2000. Ann Occup Hyg. 2006 Jan;50(1):29-38. Epub 2005 Aug 26. PMID 16126764 27 Kasım 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- Leroux C, Girard N, Cottin V, Greenland T, Mornex JF, Archer F. Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep. Vet Res. 2007 Mar-Apr;38(2):211-28. Epub 2007 Jan 25. PMID 17257570 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Cheng YW, Chiou HL, Sheu GT, Hsieh LL, Chen JT, Chen CY, Su JM, Lee H. The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women. Cancer Res. 2001 Apr 1;61(7):2799-803. PMID 11306446 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Zheng H, Abdel Aziz HO, Nakanishi Y, Masuda S, Saito H, Tsuneyama K, Takano Y. Oncogenic role of JC virus in lung cancer. J Pathol. 2007 Jul;212(3):306-15. PMID 17534844 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Giuliani L, Jaxmar T, Casadio C, Gariglio M, Manna A, D'Antonio D, Syrjanen K, Favalli C, Ciotti M. Detection of oncogenic viruses SV40, BKV, JCV, HCMV, HPV and p53 codon 72 polymorphism in lung carcinoma. Lung Cancer. 2007 Sep;57(3):273-81. Epub 2007 Apr 2. PMID 17400331 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Fong KM, Sekido Y, Gazdar AF, Minna JD. Lung cancer. 9: Molecular biology of lung cancer: clinical implications. Thorax. 2003 Oct;58(10):892-900. PMID 14514947 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Herbst RS, Heymach JV, Lippman SM. Lung cancer. N Engl J Med. 2008 Sep 25;359(13):1367-80. PMID 18815398 2 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Aviel-Ronen S, Blackhall FH, Shepherd FA, Tsao MS. K-ras mutations in non-small-cell lung carcinoma: a review. Clin Lung Cancer. 2006 Jul;8(1):30-8. PMID 16870043 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Giles F. Filley Lecture.Devereux TR, Taylor JA, Barrett JC. Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors. Chest. 1996 Mar;109(3 Suppl):14S-19S. PMID 8598134 2 Haziran 2013 tarihinde Wayback Machine sitesinde arşivlendi.
- Yilmazbayhan A, Damadoğlu E, Aybatli A. Soliter pulmoner nodüle tanısal yaklaşım. Tuberk Toraks. 2005;53(3):307-18. PMID 16258894 2 Eylül 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Inci I, Pabuşçu E. Akciğer kanserinin cerrahi tedavisinde preoperatif değerlendirme. Tuberk Toraks. 2005;53(2):210-20. PMID 16100661 15 Temmuz 2014 tarihinde Wayback Machine sitesinde arşivlendi.
- Travis WD, Travis LB, Devesa SS. Lung cancer. Cancer. 1995 Jan 1;75(1 Suppl):191-202. PMID 8000996
- Morandi U, Casali C, Rossi G. Bronchial typical carcinoid tumors. Semin Thorac Cardiovasc Surg. 2006 Fall;18(3):191-8. PMID 17185178
- Etienne-Mastroianni B, Falchero L, Chalabreysse L, Loire R, Ranchère D, Souquet PJ, Cordier JF. Primary sarcomas of the lung: a clinicopathologic study of 12 cases. Lung Cancer. 2002 Dec;38(3):283-9. PMID 12445750 4 Ocak 2017 tarihinde Wayback Machine sitesinde arşivlendi.
- Arinç S, Saltürk C, Ertuğrul M, Sulu E, Tuncer L, Nergis S, Selvi U. Primer akciğer kanserinde bronkoskopik biyopsi ve torakotomi materyalleri arasında hücre tipi uyumu. Tuberk Toraks. 2007;55(4):378-82. PMID 18224506 15 Temmuz 2014 tarihinde Wayback Machine sitesinde arşivlendi.
- Bryant A, Cerfolio RJ. Differences in epidemiology, histology, and survival between cigarette smokers and never-smokers who develop non-small cell lung cancer. Chest. 2007 Jul;132(1):185-92. Epub 2007 Jun 15. PMID 17573517 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Travis WD, Nicholson AG (editors). WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. Volume 7 of Medicine Series: WHO Classification of Tumours, International Agency for Research on Cancer, 2015
- Kumar V, Abbas AK, Aster JC. Robbins and Cotran Pathologic Basis of Disease. 9th edt., Elsevier Saunders, Philadelphia, 2015
- Raz DJ, He B, Rosell R, Jablons DM. Bronchioloalveolar carcinoma: a review. Clin Lung Cancer. 2006 Mar;7(5):313-22. PMID 16640802 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Vineis P, Hoek G, Krzyzanowski M, Vigna-Taglianti F, Veglia F, Airoldi L, Overvad K, Raaschou-Nielsen O, Clavel-Chapelon F, Linseisen J, Boeing H, Trichopoulou A, Palli D, Krogh V, Tumino R, Panico S, Bueno-De-Mesquita HB, Peeters PH, Lund E E, Agudo A, Martinez C, Dorronsoro M, Barricarte A, Cirera L, Quiros JR, Berglund G, Manjer J, Forsberg B, Day NE, Key TJ, Kaaks R, Saracci R, Riboli E. Lung cancers attributable to environmental tobacco smoke and air pollution in non-smokers in different European countries: a prospective study. Environ Health. 2007 Feb 15;6:7. PMID 17302981 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Pandey G. Bhutan's smokers face public ban. BBC, Şubat 2005. Tam metin 7 Nisan 2008 tarihinde Wayback Machine sitesinde arşivlendi. Erişim tarihi 2007-09-07.
- UN health agency calls for total ban on tobacco advertising to protect young. United Nations News service. Tam metin 4 Mart 2016 tarihinde Wayback Machine sitesinde arşivlendi. Erişim tarihi 30 Mayıs 2008.
- A Decade of Broken Promises: The 1998 State Tobacco Settlement Ten Years Later. Campaign for Tobacco-Free Kids. Tam metin 17 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi. Erişim tarihi 2008-12-03.
- Çetinkaya E, Yıldız P, Turna A, Dodurgalı R, Ürer N, Gürses A, Yılmaz V. Akciğer Tümörlerinde Ameliyat Öncesi İnvazif Tanı Yöntemlerinin Hücre Tipini Belirlemedeki Doğruluğu. Türk Toraks Dergisi. Aralık 2002, Cilt 3, Sayı 3, Sayfa(lar) 284-288. Tam metin 9 Kasım 2005 tarihinde Wayback Machine sitesinde arşivlendi.
- Öztuna F, Özlü T, Bülbül Y. Akciğer Kanserini Hangi Evrede Yakalıyor ve Nasıl Tedavi Ediyoruz? Tüberküloz ve Toraks Dergisi 2003; 51(2): 152-156. PMID 15143421
- Schiller JH, Vidaver RM, Novello S, Brahmer J, Monroe L (2007). Living with a Diagnosis of Lung Cancer, Standard Treatments for Lung Cancer. National Lung Cancer Partnership. Tam metin 23 Eylül 2009 tarihinde Wayback Machine sitesinde arşivlendi. Son erişim tarihi:2008-12-01.
- Strand TE, Rostad H, Damhuis RA, Norstein J. Risk factors for 30-day mortality after resection of lung cancer and prediction of their magnitude. Thorax. 2007 Nov;62(11):991-7. Epub 2007 Jun 15. PMID 17573442
- El-Sherif A, Gooding WE, Santos R, Pettiford B, Ferson PF, Fernando HC, Urda SJ, Luketich JD, Landreneau RJ. Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer: a 13-year analysis. Ann Thorac Surg. 2006 Aug;82(2):408-15; discussion 415-6. PMID 16863738
- Fernando HC, Santos RS, Benfield JR, Grannis FW, Keenan RJ, Luketich JD, Close JM, Landreneau RJ. Lobar and sublobar resection with and without brachytherapy for small stage IA non-small cell lung cancer. J Thorac Cardiovasc Surg. 2005 Feb;129(2):261-7. PMID 15678034
- Amerikan Göğüs Hastalıkları Birliği (ACCP 11 Temmuz 2016 tarihinde Wayback Machine sitesinde arşivlendi.)
- "The Cardiothoracic Surgery Network". 16 Ağustos 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Temmuz 2016.
- Clegg A, Scott DA, Hewitson P, Sidhu M, Waugh N. Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer: a systematic review. Thorax. 2002 Jan;57(1):20-8. PMID 11809985
- Murray N, Turrisi AT 3rd. A review of first-line treatment for small-cell lung cancer. J Thorac Oncol. 2006 Mar;1(3):270-8. PMID 17409868
- Azim HA Jr, Ganti AK. Treatment options for relapsed small-cell lung cancer. Anticancer Drugs. 2007 Mar;18(3):255-61. PMID 17264756
- Winton T, Livingston R, Johnson D, Rigas J, Johnston M, Butts C, Cormier Y, Goss G, Inculet R, Vallieres E, Fry W, Bethune D, Ayoub J, Ding K, Seymour L, Graham B, Tsao MS, Gandara D, Kesler K, Demmy T, Shepherd F; National Cancer Institute of Canada Clinical Trials Group; National Cancer Institute of the United States Intergroup JBR.10 Trial Investigators. Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N Engl J Med. 2005 Jun 23;352(25):2589-97. PMID 15972865
- Douillard JY, Rosell R, De Lena M, Carpagnano F, Ramlau R, Gonzáles-Larriba JL, Grodzki T, Pereira JR, Le Groumellec A, Lorusso V, Clary C, Torres AJ, Dahabreh J, Souquet PJ, Astudillo J, Fournel P, Artal-Cortes A, Jassem J, Koubkova L, His P, Riggi M, Hurteloup P. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncol. 2006 Sep;7(9):719-27. PMID 16945766 11 Haziran 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- Tsuboi M, Ohira T, Saji H, Miyajima K, Kajiwara N, Uchida O, Usuda J, Kato H. The present status of postoperative adjuvant chemotherapy for completely resected non-small cell lung cancer. Ann Thorac Cardiovasc Surg. 2007 Apr;13(2):73-7. PMID 17505412
- Horn L, Sandler AB, Putnam JB Jr, Johnson DH. The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer. J Thorac Oncol. 2007 May;2(5):377-83. PMID 17473651
- Wakelee HA, Schiller JH, Gandara DR. Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial. Clin Lung Cancer. 2006 Jul;8(1):18-21. PMID 16870041
- British Medical Journal (December 2005). Clinical Evidence Concise. BMJ Publishing Group. s. 486–488. ISBN 1-905545-00-2
- Saunders M, Dische S, Barrett A, Harvey A, Gibson D, Parmar M. Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial. CHART Steering Committee. Lancet. 1997 Jul 19;350(9072):161-5. PMID 9250182 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Wagner H Jr. Radiation therapy in the management of limited small cell lung cancer: when, where, and how much? Chest. 1998 Jan;113(1 Suppl):92S-100S. PMID 9438697 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- PORT Meta-analysis Trialists Group. Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev. 2005 Apr 18;(2):CD002142. PMID 15846628 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Lally BE, Zelterman D, Colasanto JM, Haffty BG, Detterbeck FC, Wilson LD. Postoperative radiotherapy for stage II or III non-small-cell lung cancer using the surveillance, epidemiology, and end results database. J Clin Oncol. 2006 Jul 1;24(19):2998-3006. Epub 2006 Jun 12. PMID 16769986 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Raben A, Mychalczak B. Brachytherapy for non-small cell lung cancer and selected neoplasms of the chest. Chest. 1997 Oct;112(4 Suppl):276S-286S. PMID 9337304 7 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Celebioglu B, Gurkan OU, Erdogan S, Savas I, Köse K, Kurtman C, Gonullu U. High dose rate endobronchial brachytherapy effectively palliates symptoms due to inoperable lung cancer. Jpn J Clin Oncol. 2002 Nov;32(11):443-8. PMID 12499415 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Ng M, Chong J, Milner A, MacManus M, Wheeler G, Wirth A, Michael M, Ganju V, McKendrick J, Ball D. Tolerability of accelerated chest irradiation and impact on survival of prophylactic cranial irradiation in patients with limited-stage small cell lung cancer: review of a single institution's experience. J Thorac Oncol. 2007 Jun;2(6):506-13. PMID 17545845 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Slotman B, Faivre-Finn C, Kramer G, Rankin E, Snee M, Hatton M, Postmus P, Collette L, Musat E, Senan S; EORTC Radiation Oncology Group and Lung Cancer Group. Prophylactic cranial irradiation in extensive small-cell lung cancer. N Engl J Med. 2007 Aug 16;357(7):664-72. PMID 17699816 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Hof H, Muenter M, Oetzel D, Hoess A, Debus J, Herfarth K. Stereotactic single-dose radiotherapy (radiosurgery) of early stage nonsmall-cell lung cancer (NSCLC). Cancer. 2007 Jul 1;110(1):148-55. PMID 17516437 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Abbas G, Danish A, Krasna MJ (Temmuz 2016). "Stereotactic Body Radiotherapy and Ablative Therapies for Lung Cancer". Surgical Oncology Clinics of North America. 25 (3). ss. 553-566. doi:10.1016/j.soc.2016.02.008.
- Simon CJ, Dupuy DE, DiPetrillo TA, Safran HP, Grieco CA, Ng T, Mayo-Smith WW. Pulmonary radiofrequency ablation: long-term safety and efficacy in 153 patients. Radiology. 2007 Apr;243(1):268-75. PMID 17392258 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Midha A, Dearden S, McCormack R (2015). "EGFR mutation incidence in non-small-cell lung cancer of adenocarcinoma histology: a systematic review and global map by ethnicity (mutMapII)". American Journal of Cancer Research. 5 (9). ss. 2892-2911. PMID PMC4633915
|pmid=değerini kontrol edin (yardım). 22 Ağustos 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ağustos 2017. - Gadgeel, Shirish M. (2015). Personalized Therapy of Non-small Cell Lung Cancer (NSCLC). Springer. ss. 203-222. 28 Ağustos 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ağustos 2017.
- Miyazaki K, Ano T, Nakazawa K, Satoh H, Ohtsuka M. Late fatal recurrence in gefitinib-treated NSCLC patients. Tuberk Toraks. 2007;55(4):400-3. PMID 18224510 27 Kasım 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- "Dabrafenib/Trametinib Combo Wins EU Approval for BRAF+ NSCLC". 28 Ağustos 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ağustos 2017.
- Sandler A, Gray R, Perry MC, Brahmer J, Schiller JH, Dowlati A, Lilenbaum R, Johnson DH. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med. 2006 Dec 14;355(24):2542-50. PMID 17167137 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Edelman MJ. Novel cytotoxic agents for non-small cell lung cancer. J Thorac Oncol. 2006 Sep;1(7):752-5. PMID 17409954 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Danesi R, Pasqualetti G, Giovannetti E, Del Tacca M. The role of pharmacogenetics in adjuvant treatment of non-small cell lung cancer. J Thorac Oncol. 2007 May;2(5 Suppl):S27-30. PMID 17457227 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Blackhall FH, Shepherd FA. Small cell lung cancer and targeted therapies. Curr Opin Oncol. 2007 Mar;19(2):103-8. PMID 17272981 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Lee JM, Mao JT, Krysan K, Dubinett SM. Significance of cyclooxygenase-2 in prognosis, targeted therapy and chemoprevention of NSCLC. Future Oncol. 2007 Apr;3(2):149-53. PMID 17381414 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Whitehead CM, Earle KA, Fetter J, Xu S, Hartman T, Chan DC, Zhao TL, Piazza G, Klein-Szanto AJ, Pamukcu R, Alila H, Bunn PA Jr, Thompson WJ. Exisulind-induced apoptosis in a non-small cell lung cancer orthotopic lung tumor model augments docetaxel treatment and contributes to increased survival. Mol Cancer Ther. 2003 May;2(5):479-88. PMID 12748310 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Scagliotti G. Proteasome inhibitors in lung cancer. Crit Rev Oncol Hematol. 2006 Jun;58(3):177-89. Epub 2006 Jan 19. PMID 16427303 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Dragnev KH, Petty WJ, Shah SJ, Lewis LD, Black CC, Memoli V, Nugent WC, Hermann T, Negro-Vilar A, Rigas JR, Dmitrovsky E. A proof-of-principle clinical trial of bexarotene in patients with non-small cell lung cancer. Clin Cancer Res. 2007 Mar 15;13(6):1794-800. PMID 17363535 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Albright C, Garst J. Vaccine therapy in non-small-cell lung cancer. Curr Oncol Rep. 2007 Jul;9(4):241-6. PMID 17588347 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Sun S, Schiller JH, Spinola M, Minna JD. New molecularly targeted therapies for lung cancer. J Clin Invest. 2007 Oct;117(10):2740-50. PMID 17909619 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- National Cancer Institute. Non-Small Cell Lung Cancer Treatment.Tam metin 8 Nisan 2015 tarihinde Wayback Machine sitesinde arşivlendi. Son düzenlenme: 08/01/2008.
- National Cancer Institute. Small Cell Lung Cancer Treatment. Tam metin 13 Mayıs 2012 tarihinde Wayback Machine sitesinde arşivlendi. Son düzenlenme: 05/22/2008.
- Mountain CF. Revisions in the International System for Staging Lung Cancer. Chest. 1997 Jun;111(6):1710-7. PMID 9187198 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- National Cancer Institute, SEER. Search Cancer Statistics Review, 1975-2002. Tam metin 6 Temmuz 2007 tarihinde Wayback Machine sitesinde arşivlendi. Retrieved 2007-11-18.
- World Health Organization. (2009) WHO Disease and injury country estimates. Tam metin 11 Kasım 2009 tarihinde Wayback Machine sitesinde arşivlendi. Erişim tarihi 11 Kasım 2009.
- Cancer of the Lung (ch.92). Vaporciyan AA, Kies MS, Stevens CW, Komaki R, Jack A. Roth JA., in Cancer Medicine. Kufe, Donald W.; Pollock, Raphael E.; Weichselbaum, Ralph R.; Bast, Robert C., Jr.; Gansler, Ted S.; Holland, James F.; Frei III, Emil, editors. Hamilton (Canada): BC Decker Inc.; c2003. Tam metin ISBN 1-55009-213-8
- Notani PN. (2001) Global variation in cancer incidence and mortality . Special section: Cancer. Current Science, vol. 81, No. 5, 10 Eylül 2001. s.465-474. 22 Aralık 2012 tarihinde Wayback Machine sitesinde arşivlendi. 22 Aralık 2012 tarihinde Wayback Machine sitesinde arşivlendi. 22 Aralık 2012 tarihinde Wayback Machine sitesinde arşivlendi. Tam metin (İngilizce).
- Youlden DR, Cramb SM, Baade PD. The International Epidemiology of Lung Cancer: geographical distribution and secular trends. J Thorac Oncol. 2008 Aug;3(8):819-31. PMID 18670299 13 Ocak 2013 tarihinde Wayback Machine sitesinde arşivlendi.
- Morgagni GB. (1761). De sedibus et causis morborum per anatomen indagatis. Tam metin 25 Ekim 2014 tarihinde Wayback Machine sitesinde arşivlendi.
- Bayle, Gaspard-Laurent (1810). Recherches sur la phtisie pulmonaire.
- Witschi H. A short history of lung cancer. Toxicol Sci. 2001 Nov;64(1):4-6. PMID 11606795 10 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Spiro SG, Silvestri GA. One hundred years of lung cancer. Am J Respir Crit Care Med. 2005 Sep 1;172(5):523-9. Epub 2005 Jun 16. PMID 15961694 10 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Adler, I (1912). Primary Malignant Growths of the Lungs and Bronchi. Longmans, Green, and Company.
- Grannis FW. History of cigarette smoking and lung cancer. smokinglungs.com. Erişim tarihi 2007-08-06. Tam metin 18 Temmuz 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- Doll R, Hill AB. Lung cancer and other causes of death in relation to smoking; a second report on the mortality of British doctors. Br Med J. 1956 Nov 10;2(5001):1071-81. PMID 13364389 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- US Department of Health Education and Welfare (1964). Smoking and health: report of the advisory committee to the Surgeon General of the Public Health Service, Washington, DC: US Government Printing Office.
- Pirozynski M. 100 years of lung cancer. Respir Med. 2006 Dec;100(12):2073-84. Epub 2006 Oct 23. PMID 17056245 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Greaves M (2000). Cancer: the Evolutionary Legacy. Oxford University Press, 196–197. ISBN 0-19-262835-6
- Office of the Home Secretary (1976). Biographical Memoirs. National Academy of Sciences. ISBN 0-309-02349-1.
- Edwards AT (1946). Carcinoma of the bronchus. Thorax 1: 1–25.
- Scott WJ, Howington J, Movsas B; American College of Chest Physicians. Treatment of stage II non-small cell lung cancer. Chest. 2003 Jan;123(1 Suppl):188S-201S. PMID 12527579 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Smythe WR; American College of Chest Physicians. Treatment of stage I non-small cell lung carcinoma. Chest. 2003 Jan;123(1 Suppl):181S-187S. PMID 12527578 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Kabela M. Experience with radical irradiation of bronchial cancer. Cesk Onkol. 1956;3(2):109-15. PMID 13383622 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Lennox SC, Flavell G, Pollock DJ, Thompson VC, Wilkins JL. Results of resection for oat-cell carcinoma of the lung. Lancet. 1968 Nov 2;2(7575):925-7. PMID 4176258 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Miller AB, Fox W, Tall R. Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus. Lancet. 1969 Sep 6;2(7619):501-5. PMID 4184834 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Cohen MH, Creaven PJ, Fossieck BE Jr, Broder LE, Selawry OS, Johnston AV, Williams CL, Minna JD. Intensive chemotherapy of small cell bronchogenic carcinoma. Cancer Treat Rep. 1977 May-Jun;61(3):349-54. PMID 194691 5 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi.
| Sınıflandırma | |
|---|---|
| Dış kaynaklar |