Arsenik
Arsenik sembolü As atom numarası 33 olan elementtir. Arsenik, çoğu mineralde, genellikle kükürt ve metallerle bir arada veya saf bir element kristali olarak bulunur . Arsenik bir metaloiddir . Çeşitli allotroplara sahiptir, ancak yalnızca metalik bir görünüme sahip gri form endüstri için önemlidir.
|
Arsenik (As) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temel özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Atom numarası | 33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Element serisi | Metaloidler | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, periyot, blok | 5A, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Görünüş | Metalik gri  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kütle numarası | 74,92160(2) g/mol g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron dizilimi | [Ar]4s23d104p3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enerji seviyesi başına Elektronlar |
1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS kayıt numarası | {{{CAS_kayıt_numarası}}} | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziksel Özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Maddenin hâli | Gaz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yoğunluk | (0 °C, 101.325 kPa)
0.00008988 g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sıvı hâldeki yoğunluğu | 2.267 g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ergime noktası | 14.01 °K (-259.14 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kaynama noktası | 20.28 °K (-252.87 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ergime ısısı | (H2) 0.117 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Buharlaşma ısısı | (H2) 0.904 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isı kapasitesi | (H2) 28.836 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal yapısı | Kübik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yükseltgenme seviyeleri | 1, -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatifliği | 2.20 Pauling ölçeği | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| İyonlaşma enerjisi | 1312.0 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom yarıçapı | 25 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom yarıçapı (hes.) | 53 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent yarıçapı | 37.3 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals yarıçapı | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diğer özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrik direnci | ((300 K) 180.5 m nΩ·m (20°C'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isıl iletkenlik | ? W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isıl genleşme | ? µm/(m·K) (25°C'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ses hızı | (gaz, 27 °C) 1310 m/s (?'de) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs sertliği | ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vickers sertliği | ? MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell sertliği | ? MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Arseniklerin birincil kullanımı kurşun alaşımlarındadır (örneğin, araba aküleri ve mühimmat ). Arsenik, yarı iletken elektronik cihazlarda yaygın bir n tipi dopanttır ve optoelektronik bileşik galyum arsenit, katkılı silikondan sonra en yaygın kullanılan ikinci yarı iletkendir. Arsenik ve bileşikleri, özellikle trioksit, pestisitlerin, işlenmiş ahşap ürünlerin, herbisitlerin ve böcek ilaçlarının üretiminde kullanılır. Bu uygulamalar arsenik ve bileşiklerinin toksisitesi nedeniyle düşmektedir.[1]
Birkaç bakteri türü, arsenik bileşiklerini solunum metaboliti olarak kullanabilir. Eser miktarda arsenik sıçanlar, hamsterler, keçiler, tavuklar ve muhtemelen diğer türlerde önemli bir diyet elemanıdır. İnsan metabolizmasındaki varsa bir rolü bilinmemektedir. Bununla birlikte, maruz kalınan miktarlar gerekenden daha büyükse, çok hücreli yaşamda arsenik zehirlenmesi meydana gelir. Yeraltı suyunun arsenik ile kirlenmesi, dünyadaki milyonlarca insanı etkileyen bir sorundur.
Birleşik Devletler Çevre Koruma Ajansı, tüm arsenik türlerinin insan sağlığı için ciddi bir risk olduğunu belirtmektedir.[2] Amerika Birleşik Devletleri'nin Zehirli Maddeler ve Hastalık Dairesi Ajansı, 2001 yılında Superfund bölgelerinde Tehlikeli Maddeler Öncelikli Listesinde 1 numaraya arseniki konumlanmıştır.[2] Arsenik, A Grubu kanserojen olarak sınıflandırılmıştır.[2]
Özellikleri
Fiziksel özellikler
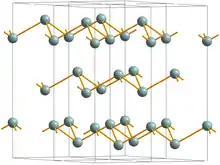
En yaygın üç arsenik allotropu gri, sarı ve siyah arseniktir, gri ise en yaygın olanıdır.[3] Gri arsenik (α-de, uzam grubu 3 m No. 166), birsürü birbirine kitli, dalgalı, altı elemanlı halkadan oluşan iki katmanlı bir yapıya sahiptir. Katmanlar arasındaki zayıf bağlanma nedeniyle, gri arsenik kırılgandır ve nispeten düşük bir Mohs sertliği' ne, 3.5, sahiptir. Aynı çift katmandaki üç atom, bir sonraki üç atomdan biraz daha yakın olacak şekilde en yakın ve sonraki en yakın komşular çarpık bir oktahedral kompleks oluşturur.[4] Bu nispeten yakın paketleme, yüksek bir yoğunluk olarak değerlendirilen 5.73 g/cm3 yoğunluğa yol açar.[5] Gri arsenik bir semimetaldir, ancak eğer amorfize edilirse 1.2–1.4 eV bant aralığı ile yarı iletken olur.[6] Gri arsenik aynı zamanda en stabil formdur. Sarı arsenik yumuşak ve kolay şekil alan cinstendir ve tetrafosforla biraz benzer ( P4 ).[7] Her ikisi de, her bir atomun diğer üç atomun her birine tek bir bağla bağlandığı dört yüzlü bir yapıda düzenlenmiş dört atoma sahiptir. Moleküler olan bu dengesiz allotrop en uçucu, en az yoğun ve en zehirli olandır. Katı sarı bir arsenik, As4 arsenik buharının hızlı soğuması ile elde edilir As4 . Işıkla beraber hızla gri arsenike dönüşür. Sarı form 1,97 g/cm3 yoğunluğa sahiptir.[5] Siyah arsenik, yapı olarak siyah fosforla benzerdir.[5] Siyah arsenik ayrıca 100-220 °C civarında bir buharın soğutulmasıyla da oluşturulabilir. Camsı ve kırılgandır. Aynı zamanda zayıf bir elektrik iletkenidir.[8]
İzotopları
Arsenik doğada tek bir kararlı izotoptan, 75 As, ibaret olan monoisotopik bir elementtir,.[9] 2003 itibarıyla, atom kütlesi 60 ila 92 arasında değişen en az 33 radyoizotop sentezlendi. Bunlardan en kararlısı yarı-ömrü 80,30 olan 73As' dir. Diğer tüm izotoplar, 71 As ( t 1/2 = 65.30 saat), 72 As ( t 1/2 = 26.0 saat), 74 As ( t 1/2 = 17.77 gün hariç), 76 As ( t 1/2 = 1.0942 gün) ve 77 As ( t 1/2 = 38.83 saat), bir günden az ömürlüdür. Kararlı 75 As' den daha hafif olan izotoplar β+ bozulma eğilimi gösterirken daha ağır olanlar bazı istisnalar dışında β - bozulma ile bozulma eğilimindedir.
Atom kütlesi 66 ile 84 arasında değişen en az 10 nükleer izomer tanımlanmıştır. Arsenik izomerlerinin en kararlısı, 111 saniye yarı-ömürü ile 68mAs' dir.[9]
Kimya
Arsenik, daha hafif türdeşi olan fosfora benzer bir elektronegativite ve iyonlaşma enerjisine sahiptir ve bu haliyle ametallerin çoğu ile kolayca kovalent moleküller oluşturur. Kuru havada stabil olmasına rağmen, arsenik neme maruz kalması üzerine altın bronz bir leke oluşturur ve bu leke sonunda siyah bir yüzey tabakası halini alır.[10] Havada ısıtıldığında, arsenik arsenik trioksitlere yükseltgenir ; Bu reaksiyondan çıkan dumanlar, sarımsağa benzer bir kokuya sahiptir. Bu koku, arsenopirit gibi arsenür minerallerine bir çekiçle vurulmasıyla tespit edilebilir. Daha iyi bilinen fosfor bileşikleri ile aynı yapıya sahip olan arsenik trioksit ve arsenik pentoksiti oluşturmak için arsenik oksijende yanar ve arsenik pentaflorür verecek şekilde de florinde yanar.[10] Arsenik (ve bazı arsenik bileşikleri) atmosferik basınçta ısıtıldığında 887 K (614 °C)' de süblime olur, araya giren sıvı halleri olmadan doğrudan gaz haline dönüşür. Üçlü noktası 3,63 MPa ve 1.090 K (820 °C) .[5] Arsenik konsantre haldeki nitrik asit ile tepkime verdiğinde arsenik asit, seyreltik nitrik asit ile tepkime verdiğinde arsenikli asiti ve sülfürik asit ile tepkime verdiğinde ise arsenik trioksit oluşur ; ancak, su, alkaliler veya oksitleyici olmayan asitlerle reaksiyona girmez.[11] Arsenik arsenürler oluşturmak üzere metaller ile reaksiyona girer fakat bu reaksiyonun ürünleri As3− iyonunu içeren iyonik bileşikler olamaz çünkü As3- anyonun oluşması oldukça endotermik bir olaydır. Buna ek olarak, grup 1 arsenürler bile metaller arası bileşiklerin özelliklerine sahiptirler.[10] Arsenik gibi 3d geçiş serileri olan germanyum, selenyum ve broma benzer olarak arsenik +5 grup oksidasyon durumunda dikey komşuları fosfor ve antimondan çok daha az kararlıdır ve dolayısıyla arsenik pentoksit ve arsenik asit güçlü oksitleyicilerdir.[10]
Bileşikler
Arsenik bileşikleri bazı açılardan periyodik tablonun aynı grubunu (sütununu) kaplayan fosforunkilere benzer. En yaygın oksidasyon durumları alaşım gibi metaller arası bileşiklere benzeyen arsenürlerdeki arsenik için: -3 arsenitlerde +3, arsenatlar ve çoğu organoarsenik bileşiklerde +5. Skutterudit mineralinde görülen As3−4 iyonlarının oluşturduğu karede görülebileceği gibi arsenik aynı zamanda kendi ile de bağ kurabilir.[12] +3 oksidasyon durumunda, arsenik, yalnız elektron çiftinin etkisiyle tipik olarak piramidaldir.[3]
İnorganik bileşikler
En basit arsenik bileşiklerinden bir arsenik trihidratdır. Arsin (ASH 3) son derece zehirli, yanıcı ve piroforikdir . Bu bileşik genel olarak kararlıdır, çünkü oda sıcaklığında sadece yavaşça ayrışır. 250–300 °C sıcaklıklarında arsenik ve hidrojene ayrışma hızlıdır.[13] Nem, ışık ve bazı katalizörler (alüminyum) gibi çeşitli faktörler ayrışma hızını arttırır.[14]Arsenik trioksit ve su oluşturmak için arsenik havada kolayca okside olur ve benzer reaksiyonlar oksijen yerine kükürt ve selenyum ile de gerçekleşir.[13]
Arsenik formları renksiz, kokusuz, kristal oksitler As2O3 ( " beyaz arsenik ") ve As2O5 olan higroskopik asidik çözeltiler oluşturmak üzere, su içinde kolaylıkla çözünebilir. Arsenik (V) asidi zayıf bir asittir ve tuzlara arsenatlar,[15] yeraltı suyunun en yaygın arsenik kirlenmesi ve birçok insanı etkileyen bir sorun denir. Sentetik arsenatlar Scheele'nin Yeşili (kuprik hidrojen arsenat, asidik bakır arsenat), kalsiyum arsenat ve kurşun hidrojen arsenatı içerir . Bu üç tarımsal böcek ilacı ve zehir olarak kullanılmıştır.
Arsenik ve arsenik asit arasındaki protonasyon adımları, fosfat ve fosforik asit arasındakilere benzer. Fosforlu asitten farklı olarak, arsenikli asit As (OH) 3 formülüyle tribazıktır.[15]
Çok çeşitli kükürt arsenik bileşikleri bilinmektedir. Orpiment (As2S3) and realgar (As4S4) biraz doğada boldur ve eski boya pigmentleri olarak kullanılmışlardır. As4S10' de arsenik +2 formak yükseltgenme halindedir. As-As bağları içeren As4S4' te toplam kovalent bağ yine 3'tür.[2] Hem Orpiment, realgar ve yanı sıra As4S3, selenyum analoglarına sahiptir; Analog As2Te 3 kalgoorlieite minerali olarak da bilinir.[2] Kobalt komplexlerinde bir ligand olarak bilinen anyon As2Te− başka bir selenyum analogu örneğidir.[16]
Arsenik (III) 'ün tüm trihalidleri, bilinmeyen astatid hariç iyi bilinmektedir. Arsenik pentaflorür (AsF 5 ) +5 oksidasyon durumunun düşük stabilitesini yansıtan tek önemli pentahaliddir; Yine de, çok güçlü bir florlama ve oksitleyici ajandır. ( Pentaklorür sadece −50 °C' nin altında karalıdır, penta klorür tam −50 °C sıcaklıkta klor gazı açığa çıkararak triklorüre ayrışır.[5]
Alaşımlar
Arsenik, III-V yarı iletken gallium arsenit, indiyum arsenit ve alüminyum arsenitte grup 5 element olarak kullanılır.[14] GaAs' ların değerlik elektron sayısı, bir çift Si atomuyla aynıdır, ancak bant yapısı tamamen farklıdır ve bu durum belirgin kütle özellikleri ile sonuçlanır.[17] Diğer arsenik alaşımları arasında II-V yarı iletken kadmiyum arsenit bulunur .[18]
Organoarsenik bileşikler
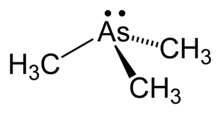
Çok çeşitli organoarsenik bileşikler bilinmektedir. Birkaçı I. Dünya Savaşı sırasında kimyasal savaş ajanları olarak geliştirildi, bunların arasında deride kabarcıklara sebebiyet veren tipte lewisite ve bir kusma ajanaı Adamzit vardır.[19][20][21] Tarihsel ve pratik açıdan ilgi çeken Kakodilic asit, fosfor kimyasında analoğu olmayan bir reaksiyon olan arsenik trioksitin metilasyonundan elde edilir. Aslında, kokdil bilinen ilk organometalik bileşikti (arsenik gerçek bir metal olmasa da). İsmi rahatsız edici kokusu sebebiyle verilmiştir. Kokdil Yunanca κακωδἰα "pis koku " kelimesinden gelir ve çok zehirlidir.[22]
Biyolojik etkiler
Esansiyel İz Element olması
Arseniğin kuşlar (tavuk) ve rat, hamster ve keçi gibi memelilerde esansiyel bir iz element olduğuna dair bulgular elde edilmiş, ancak esansiyel fonksiyonun mekanizması ortaya konulamamıştır.[23]
Arsenik zehirlenmesi
Çeşitli arsenik bileşiklerinin vücut dokuları ve fonksiyonları üzerindeki zararlı etkileridir. Arsenikli bileşikler, böcek ve tarım ilaçları, fare zehiri, bazı kanser ilaçları, boya, duvar kağıdı, seramik gibi çeşitli ürünlerin imalatında kullanılır.
İnsanda arsenik zehirlenmesi, genellikle arsenik -3- oksit (arsenik anhidrit), bakır asetoarsenit, kalsiyum veya kurşun arsenat gibi arsenik bileşikleriyle hazırlanmış böcek ilaçlarının ağız veya teneffüs yoluyla alınmasından meydana gelir. İlaçlı meyve ve sebzelerin yıkanmadan yenmesi de zehirlenmeye yol açacak seviyede arseniğin vücutta birikmesine sebep olabilir.
Arseniğin zehirli etkilerinin, vücuttaki bazı enzimlerle birleşerek hücre metabolizmasına bozucu etkide bulunmasından ileri geldiği zannedilmektedir. Arsenik zehirlenmesi, ya bir kerede alınan yüksek dozda arsenikten (akut zehirlenme) veya küçük dozlarda art arda alınmaktan (kronik zehirlenme) kaynaklanır. Akut zehirlenmenin başlıca belirtileri mide bulantısı, kusma, ağız ve boğazda yanma ve şiddetli karın ağrılarıdır. Bunu takiben dolaşım bozukluğu ve kalp yetersizliği başlar ve birkaç saat içinde zehirlenme ölümle neticelenebilir. Kronik zehirlenme ise, yavaş yavaş güçten düşme, boşaltım bozuklukları, deride tümör meydana gelmesi, şuur bozukluğu, sinir sistemi bozukluğu, kansızlık ve tırnaklarda tipik çizgilerin belirmesiyle belli olur. Akut arsenik zehirlenmesinde ilk iş mideyi yıkamak ve zaman kaybetmeden dimerkaprol ilacını almaktır. Arsenik-3- oksit renksiz ve tatsız bir tozdur. Adli tıpta kimyasal araştırma tekniklerinin geliştirilmesine kadar cinayet amacıyla en çok kullanılan zehirlerin başında geliyordu.
Arsenik zehirlenmelerinde kullanılacak spesifik antidot Dimerkaprol(BAL;British Anti Levisit)'dür.
Arsenik antik çağlarda tunç yapımında da kullanılmıştır fakat sertliği ve kalitesi Kalay + Bakır alaşımıyla yapılan tunçtan daha düşüktür.
Kaynakça
- Grund, Sabina C.; Hanusch, Kunibert; Wolf, Hans Uwe. "Arsenic and Arsenic Compounds". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_113.pub2.
- Dibyendu, Sarkar; Datta, Rupali (2007). "Biogeochemistry of Arsenic in Contaminated Soils of Superfund Sites". EPA. United States Environmental Protection Agency. 26 Şubat 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Şubat 2018.
- N.C. Norman (31 Aralık 1997). Chemistry of Arsenic, Antimony and Bismuth (İngilizce). Springer Science & Business Media. ISBN 978-0-7514-0389-3.
- Egon Wiberg; A. F. Holleman; Nils Wiberg (2001). Inorganic Chemistry (İngilizce). Academic Press. ISBN 978-0-12-352651-9. 7 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Eylül 2020.
- Arnold F. Holleman; Egon Wiberg; Nils Wiberg (1985). Lehrbuch der anorganischen Chemie (Almanca). De Gruyter. ISBN 978-3-11-007511-3.
- Otfried Madelung (2004). Semiconductors (İngilizce). Springer Science & Business Media. ISBN 978-3-540-40488-0. 30 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Haziran 2019.
- Seidl, Michael; Balázs, Gábor; Scheer, Manfred (22 Mart 2019). "The Chemistry of Yellow Arsenic". Chemical Reviews. 119 (14): 8406-8434. doi:10.1021/acs.chemrev.8b00713. PMID 30900440.
- Arsenic Element Facts 24 Haziran 2019 tarihinde Wayback Machine sitesinde arşivlendi.. chemicool.com
- Şablon:NUBASE 2003
- Greenwood and Earnshaw, pp. 552–4
-
 Chisholm, Hugh, (Ed.) (1911). "Arsenic". Encyclopædia Britannica. 2 (11. bas.). Cambridge University Press. ss. 651–654.
Chisholm, Hugh, (Ed.) (1911). "Arsenic". Encyclopædia Britannica. 2 (11. bas.). Cambridge University Press. ss. 651–654. - Advances in Thermoelectric Materials I (İngilizce). Academic Press. 13 Kasım 2000. ISBN 978-0-12-752178-7.
- Greenwood and Earnshaw, pp. 557–8
- Institut National de Recherche et de Sécurité (2000). "Fiche toxicologique nº 53: Trihydrure d'arsenic" (PDF). 26 Kasım 2006 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 6 Eylül 2006.
- Greenwood and Earnshaw, pp. 572–8
- Greenwood and Earnshaw, pp. 578–83
- Stefano Ossicini; Lorenzo Pavesi; Francesco Priolo (12 Kasım 2003). Light Emitting Silicon for Microphotonics (İngilizce). Springer Science & Business Media. ISBN 978-3-540-40233-6. 7 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Haziran 2019.
- Sahbudin Shaari (1998). Proceedings (İngilizce). ISBN 978-0-7803-4971-1.
- Ellison, D. Hank (Ağustos 2007). Handbook of Chemical and Biological Warfare Agents (2. bas.). CNC Press. ISBN 978-0-8493-1434-6.
- James Girard (22 Eylül 2009). Principles of Environmental Chemistry (İngilizce). Jones & Bartlett Learning. ISBN 978-0-7637-5939-1.
- Satu M. Somani; James A. Romano, Jr., (Edl.) (Aralık 2000). Chemical Warfare Agents: Toxicity at Low Levels (1. bas.). CRC Press. ISBN 978-0-8493-0872-7.
- Greenwood, p. 584
- Anke M. Arsenic. In: Mertz W. ed., Trace elements in human and Animal Nutrition, 5th ed. Orlando, FL: Academic Press, 1986, 347-372; Uthus E.O., Evidency for arsenical essentiality, Environ. Geochem. Health, 1992, 14:54-56; Uthus E.O., Arsenic essentiality and factors affecting its importance. In: Chappell W.R, Abernathy C.O, Cothern C.R. eds., Arsenic Exposure and Health. Northwood, UK: Science and Technology Letters, 1994, 199-208
Bibiliyografi
- John Emsley (25 Ağustos 2011). Nature's Building Blocks (İngilizce). Oxford University Press. ISBN 978-0-19-960563-7.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- John Rieuwerts (14 Nisan 2015). The Elements of Environmental Pollution (İngilizce). Routledge. ISBN 978-0-41-585920-2.
Konuyla ilgili yayınlar
- James C. Whorton (2011). The Arsenic Century (İngilizce). Oxford University Press, USA. ISBN 978-0-19-960599-6.
Dış bağlantılar
- CTD's Arsenic page2 Nisan 2012 tarihinde Wayback Machine sitesinde arşivlendi. and CTD's Arsenicals page2 Nisan 2012 tarihinde Wayback Machine sitesinde arşivlendi. from the Comparative Toxicogenomics Database
- A Small Dose of Toxicology
- Arsenic in groundwater7 Nisan 2019 tarihinde Wayback Machine sitesinde arşivlendi. Book on arsenic in groundwater by IAH's Netherlands Chapter and the Netherlands Hydrological Society
- Contaminant Focus: Arsenic1 Eylül 2009 tarihinde Wayback Machine sitesinde arşivlendi. by the EPA.
- Environmental Health Criteria for Arsenic and Arsenic Compounds, 20013 Ağustos 2009 tarihinde Wayback Machine sitesinde arşivlendi. by the WHO.
- Evaluation of the carcinogenicity of arsenic and arsenic compounds20 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi. by the IARC.
- National Institute for Occupational Safety and Health – Arsenic Page16 Haziran 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Arsenic11 Haziran 2019 tarihinde Wayback Machine sitesinde arşivlendi. at The Periodic Table of Videos (University of Nottingham)
