Titanyum
Titanyum sembolü Ti olan 22 atom numaralı kimyasal elementtir. Hafif, güçlü, parlak, korozyona karşı dirençli grimsi bir geçiş metalidir. Titanyum demir, alüminyum, vanadyum, molibden gibi elementler ile alaşım yapabilir. Bu güçlü, hafif alaşımlar havacılık (jet motorları, füzeler ve uzay araçları) askeri, endüstriyel işlemler (kimyasallar ve petrokimyasallar, arıtma santralleri, kâğıt hamuru ve kâğıt) otomotiv, yiyecek, tıp (protezler, implantlar , dental endodontik malzemeler, dental implantlar), spor eşyaları, mücevher, cep telefonu, ve diğer uygulamalarda kullanılır.[1] Titanyum 1791'de William Gregor tarafından İngiltere'de keşfedildi ve Martin Heinrich Klaproth tarafından, Yunan mitolojisindeki Titan'a atfen bu şekilde isimlendirildi.
| |||||||||||||||
| Genel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Adı, Sembolü, Atom numarası | Titanyum, Ti, 22 | ||||||||||||||
| Element serisi | Geçiş metalleri | ||||||||||||||
| grup, periyot, blok | 4, 4, d | ||||||||||||||
| Görünüş | Gümüş gri metalik beyaz  | ||||||||||||||
| Atom ağırlığı | 47.867 g·mol−1 | ||||||||||||||
| Elektron dizilimi | [Ar] 3d2 4s2 | ||||||||||||||
| Enerji seviyesi başına Elektronlar | 2, 8, 10, 2 | ||||||||||||||
| Fiziksel özellikleri | |||||||||||||||
| Maddenin hâlleri | katı | ||||||||||||||
| Yoğunluk (o.s.) | 4.506 g·cm−3 | ||||||||||||||
| Erime noktası | 1941 K 1668 °C, 3034 °F) | ||||||||||||||
| Kaynama noktası | 3560 K 3287 °C, ? 5949 °F) | ||||||||||||||
| Erime | 14.15 kJ·mol−1 | ||||||||||||||
| Buharlaşma ısısı | 425 kJ·mol−1 | ||||||||||||||
| |||||||||||||||
| Atom özellikleri | |||||||||||||||
| Kristal yapısı | hegzagonal | ||||||||||||||
| Yükseltgenme seviyesi | 4, 3, 2, 1 | ||||||||||||||
| Elektronegatifliği | 1.54 (Pauling ölçeği) | ||||||||||||||
| İyonlaşma enerjileri | 1.: 658.8 kJ/mol | ||||||||||||||
| 2.: 1309.8 kJ/mol | |||||||||||||||
| 3.: 2652.5 kJ/mol | |||||||||||||||
| Atomik yarıçapı | 140 pm | ||||||||||||||
| Kovalent yarıçapı | 136 pm | ||||||||||||||
| Diğer özellikleri | |||||||||||||||
| Isıl iletkenlik | (300 K) 21.9 W·m−1·K−1 | ||||||||||||||
| CAS kayıt numarası | 7440-32-6 | ||||||||||||||
| Elektrik direnci | (20 °C) 0.420 µΩ·m | ||||||||||||||
| Elastisite modülü | 116 GPa | ||||||||||||||
| Bulk modülü | 110 GPa | ||||||||||||||
Element birkaç mineral depozitde bulunur. Bunlardan öncelikli olanlar yer kabuğunda ve litosferde genişce dağılmış olan rutil ve ilmenittir. Titanyum neredeyse tüm canlı varlıklarda, kayalarda, sularda ve toprakta bulunur.[1] Metal başlıca mineral cevherlerinden Kroll işlemi ve Hunter işlemi yöntemleri ile çıkarılır. En yaygın bileşiği olan titanyum dioksit beyaz pigment imalatında kullanılır.[2] Diğer bileşiklerinden titanyum tetraklorid (TiCl4) sis perdelerinde/havaya yazı yazımında kullanılır, katalizör olarak kullanılır ve titanyum triklorid polipropilen imalatında katalizör olarak kullanılır.[1]
Metal formun en yararlı özellikleri korozyona karşı dirençli olması ve bütün metaller içinde en yüksek dayanıklılık-ağırlık oranına sahip olmasıdır.[3] Alaşımsız haliyle %45 daha hafif olmasına rağmen bazı çelikler kadar dayanıklıdır.[4] Elementin iki allotropik türü[5] ve 46Ti'den 50Ti'ye beş tane doğal izotopu bulunur. Bunlardan 48Ti doğal olarak en bol bulunan izotoptur (73.8%).[6] Titanyumun kimyasal ve fiziksel özellikleri zirkonyumunkiler ile benzerlik gösterir.
Tarih
Titanyum, 1791'de Cornwall, İngiltere'de amatör jeolog ve papaz olan William Gregor tarafından bir mineralde keşfedildi. O Manaccan(en) bölgesi yakınlarındaki akarsuda siyah kumlar buldu ve kumların mıknatısla etkilendiğine dikkat etti böylece ilmenitin içinde yeni bir elementin varolduğunu düşündü.[2]. Kumun analizi iki metal oksidin varolduğunu gösterdi, biri demir oksit (ki bu mıknatıstan etkilenmeyi açıklıyor) ve %45.25 oranında Gregor'ın tanımlayamadığı beyaz bir metal oksit.[4] Gregor, tanımlayamadığı oksitin bilinen hiçbir elementin özelliklerine uymadığını fark etti ve bulgularını Royal Geological Society of Cornwall'de ve Alman bilim dergisi Crell's Annalen 'de bildirdi.[7]

Aynı zaman zarfında Franz Joseph Muller de tanımlayamadığı benzer bir maddeyi üretti.[2] Bunlardan bağımsız olarak Alman kimyager Martin Heinrich Klaproth 1795'te Macaristan'da bir rutilde oksidi yeniden keşfetti.[8] Klaproth oksidin yeni bir element içerdiğini buldu ve elemente titanyum ismini verdi.[7] Gregor'ın daha önceki keşfini duyduğunda bir miktar manaccanite örneği elde etti ve bunun titanyum içerdiğini doğruladı.
Titanyumun cevherlerinden çıkarmak zahmetli ve pahalı bir süreç gerektirir. Titanyumu karbonun varlığında normal biçimde ısıtarak ayırmak mümkün değildir, çünkü bu işlemin sonucu titanyum karbittir.[7] Saf metalik titanyum (99.9%) ilk olarak Matthew A. Hunter tarafından 1910'da Hunter işleminde TiCl4 ile sodyumun 700–800 °C'de ısıtılmasıyla hazırlandı.[9]
Titanyum metali William Justin Kroll'un Kroll işleminde titanyum tetraklorid ile magnezyumu eritip metalin ticari anlamda kullanılabilir olduğunu kanıtladığı 1946'ya kadar laboratuvar dışında kullanılmadı. Daha verimli ve daha ucuz işlemler konusunda çalışmalar (örneğin; FFC Cambridge (en)) devam etse de ticari üretim için hâlen Kroll işlemi kullanılmaktadır.[2][9]

1925'te Anton Eduard van Arkel ve Jan Hendrik de Boer iyodür veya kristal çubuk işlemini keşfettiklerinde az miktarda çok yüksek saflıktaki titanyum elde edildi.[10]
1950'lerde ve 1960'larda Sovyetler Birliği titanyumun askeri ve denizaltı uygulamalarında kullanımının öncüsü oldu (Alfa sınıfı ve Mike Class).[11] Sovyetlerin bu uygulamaları Soğuk Savaş ile ilgili programlarının bir parçasıydı.[12] 1950'lere girilirken titanyum, F-100 Super Sabre ve Lockheed A-12 gibi uçaklarda kullanılmasıyla özellikle yüksek performanslı jetlerde olmak üzere askeri havacılıkta geniş bir şekilde kullanılmaya başlandı. ABD'de Savunma Bakanlığı metalin stratejik öneminin farkına vardığında[13] ilk ticarileştirme çabalarını destekledi.[14] Soğuk Savaş dönemi boyunca ABD hükûmeti titanyumu Stratejik Materyal olarak düşündü ve büyük bir titanyum süngeri stoğunu Defense National Stockpile Center'da sakladı. Bu stok nihayet 2005'te tüketildi.[15] Bugün dünyanın en büyük titanyum üreticisi dünya pazar payının %29'unu elinde bulunduran Rusya kökenli VSMPO-Avisma'dır.[16]
Karakteristik
Fiziksel
Metalik bir ak element olan titanyum sahip olduğu yüksek dayanıklılık-ağırlık oranı ile bilinir.[5] Düşük yoğunluklu hafif ve güçlü bir metaldir. Saf haliyle tamamen esnektir (özellikle oksijensiz ortamda).[17] Parlak, metalik beyaz renklidir. Göreli olarak yüksek erime noktası ((1,649 °C or 3,000 °F'nin üstünde)) ile dayanıklı metallerden olması açısından kullanışlıdır.
Ticari sınıf (%99.2 saf) titanyum yaklaşık 63,000 psi (434 MPa) tensil (gerilme) gücüne sahiptir. Bu birçok çelik alaşımın tensil gücüne eşittir ancak titanyum %45 oranında daha hafiftir.[4] Titanyum alüminyumdan %60 oranında daha ağır olmasına rağmen en yaygın olarak kullanılan aluminyum alaşımı 6061-T6'dan iki kat daha güçlüdür.[4]. Belli titanyum alaşımlarının (örneğin Beta C) tensil gücü 200,000 psi'ın (1380 MPa) üzerine kadar çıkabilir.[18] Yine de 430 °C'nin (800 °F) üzerinde ısıtıldığında titanyum dayanıklılığını yitirmeye başlar.[4]
Titanyum (ısı işlemi uygulanmış bazı cins çelikler kadar olmasa da) oldukça sert, antimanyetik ve zayıf bir ısı iletkenidir. Çelikte olduğu gibi titanyum yapılarında yaşam süresini garanti eden bir yorulma sınırı vardır.[19]
Metal dimorfik allotroptur. Kristal yapısı 882 °C'de (1,619 °F) cisim merkezli kübik beta formdan hegzagonal alfa forma değişir.[4] Alfa formunun özgül ısısı titanyum geçiş sıcaklığına ulaşıncaya kadar çarpıcı bir şekilde yükselir sonra tekrar düşer ve sabit kalır, beta form için ise sıcaklıktan bağımsızdır.[4]
Zirkonyum ve hafniyuma benzer şekilde, ekstra bir omega fazı vardır, bu faz yüksek basınçlarda termodinamiksel olarak kararlıdır ancak normal basınçta yarı kararlı olabilir.
Kimyasal
Titanyumun en ünlü kimyasal özelliği korozyona karşı gösterdiği müthiş direncidir. Neredeyse platin kadar dirençli olan element asitler, klor gazı ve yaygın tuz çözeltilerinin maruziyetine karşı koyabilecek yeterliliktedir.[5] Saf titanyum su içerisinde çözünmez ancak yoğun asit içinde çözünebilir.[20]
Pourbaix diagramı titanyumun termodinamik olarak çok reaktif bir metal olduğunu gösterir. Titanyumun su ve hava tepkimesi yavaştır.
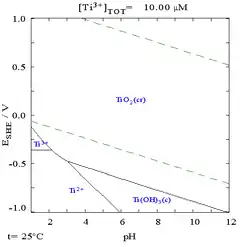
Bu metal havada yükseltilmiş sıcaklıklarda pasif ve (korozyon direncini artıran) koruyucu bir tabaka oluşturur, ancak oda sıcaklığında kararmaya karşı dirençlidir.[17] İlk oluşumda bu tabaka sadece 1–2 nm kalınlığındadır, ancak kalınlık zamanla yavaşça artmaya devam eder (dört yıl içinde 25 nm'lik bir kalınlığa ulaşır).[7]
Titanyum havada 610 °C (1,130 °F) ve daha yüksek sıcaklıklarda titanyum dioksit oluşturarak yanar.[5] Titanyum ayrıca saf azot içinde yanan birkaç elementten biridir (800 °C veya 1,472 °F sıcaklığında yanarak titanyum nitrit oluşturur).[22] Titanyum klor gazı, klorid solüsyonları ve organik asitlerin çoğu ile birlikte, seyreltik sülfürik ve hidroklorik aside karşı dirençlidir.[9] Element paramanyetiktir (mıknatısla zayıf etkileşim gösterir) ve elektriksel ve ısıl iletkenliği düşüktür.[17]
Deneyler doğal titanyum döteron ile bombardıman edildiğinde radyoaktif hale geldiğini gösterdi. Bu durumda titanyum pozitronlar ve şiddetli gama ışınları yayımlar.[9] Kızarmış bir metal olduğunda oksijenle ve sıcaklığı 550 °C'ye (1,022 °F) ulaştığında klor ile bileşik oluşturur.[9] Titanyum ayrıca diğer halojenlerle de reaksiyona girer ve hidrojen
Bulunuş
| Üretici | Bin ton | Toplamdaki % |
|---|---|---|
| Avustralya | 1291.0 | 30.6 |
| Güney Afrika | 850.0 | 20.1 |
| Kanada | 767.0 | 18.2 |
| Norveç | 382.9 | 9.1 |
| Ukrayna | 357.0 | 8.5 |
| Diğer ülkeler | 573.1 | 13.6 |
| Toplam | 4221.0 | 100.1 |
Yuvarlamalar yüzünden toplam % 100 değildir.
Titanyum doğada her zaman diğer elementler ile bağlı bir şekilde bulunur.Yer kabuğunda dokuzuncu en bol bulunan elementtir (kütle ile % 0.63)[4] ve dördüncü en bol bulunan metaldir. Titanyum volkanik kayalarda, tortul tabakalarda bulunur ve bunlardan çıkarılır.[9][17] United States Geological Survey tarafından analiz edilen 801 çeşit volkanik kayadan 784 tanesinde titanyum tespit edilmiştir.[4] Topraklarda bulunma oranı yaklaşık olarak % 0.5, 1.5 arasındadır.[4]
Titanyum öncelikli olarak anataz, brukit, ilmenit, perovskit, rutil, titanit (sfene) minerallerinde ve birçok demir cevherinde geniş ölçüde yayılmıştır. Bu minerallerden, titanyumu yüksek konsantrasyonda bulmak zor olsa da sadece rutil ve ilmenit ekonomik öneme sahiptir.[2] Titanyum içeren önemli ilmenit birikimleri batı Avustralya, Kanada, Çin, Yeni Zelanda, Norveç, Hindistan ve Ukrayna'da bulunur. Büyük miktarlarda rutil Kuzey Amerika ve Güney Amerika'da çıkarılır ve buralardan çıkarılan maden toplam yıllık üretime metalden 90,000 ton ve titanyum dioksitten 4.3 milyon ton katkıda bulunur. Titanyumun bilinen toplam rezervi yaklaşık olarak 600 milyon tondur.[7]
Titanyum meteorlarda da bulunur ayrıca güneş ve M tipi yıldızlarda (3,200 °C (5,792 °F) yüzey sıcaklığı ile en soğuk yıldız tipidir[7]) bulunduğu tespit edildi.[9] Apollo 17 görevi kapsamında aydan dünyaya getirilen kayaçlarda 12.1% oranında TiO2 tespit edildi.[9] Titanyum ayrıca kömür küllerinde, bitkilerde ve hatta insan vücudunda da bulunur.
Üretim

Titanyumun işlenmesi dört büyük aşamadan oluşur:[24] titanyum cevherinin gözenekli bir form olan süngere redüksiyonu; süngerin veya sünger ve bir sertleştirme alaşımının bir külçe oluşturmak için eritilmesi; külçenin ham metal kütük, çubuk, levha, şerit ve boru gibi genel fabrika ürünlerine dönüştürüldüğü birinci fabrikasyon; ve fabrika ürünlerinden elde edilen son mamullerin ikici fabrikasyonu.
Metal yüksek sıcaklıklarda oksijen ile reaksiyon verdiği için kendi dioksidinin redüksiyonu ile üretilemez.
Bu yüzden titanyum metali ticari olarak, karmaşık ve pahalı bir yığın işleme metodu olan Kroll süreci ile üretilir. (Titanyumun göreli olarak yüksek piyasa değeri esas olarak metalin bir diğer pahalı metal olan magnezyumun feda edildiği işlem süreciyle bağlantılıdır.[4]) Kroll sürecinde ilk olarak oksit klorlama yöntemi ile klorüre dönüştürülür. Bu sayede klor gazı, karbonun varlığında TiCl4 oluşması için akkor rutil veya ilmenite geçiş yapar.
En son geliştirilen bir metot olan FFC Cambridge işlemi(en)[25] Kroll işleminin yerini alabilir. Bu metot toz ya da sünger olan son ürünün yapımında hammadde olarak rutilin arıtılmış formu olan titanyum dioksit tozunu kullanır.
Notlar
- "Titanium". Encyclopædia Britannica Concise. 2007.
- Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide (2nd edition). Westport, CT: Greenwood Press. ISBN 0-313-33438-2.
- Matthew J. Donachie, Jr. (1988). TITANIUM: A Technical Guide. Metals Park, OH: ASM International. ss. sf.11. ISBN 0-87170-309-2.
- Barksdale, Jelks (1968). The Encyclopedia of the Chemical Elements. Skokie, Illinois: Reinhold Book Corporation. ss. 732-38 "Titanium". LCCCN 68-29938.
- "Titanium". Columbia Encyclopedia (6th edition bas.). New York: Columbia University Press. 2000 – 2006. ISBN 0-7876-5015-3. Tarih değerini gözden geçirin:
|yıl=(yardım) - Barbalace, Kenneth L. (2006). "Periodic Table of Elements: Ti - Titanium". Erişim tarihi: 26 Aralık 2006.
- Emsley, John (2001). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford: Oxford University Press. ss. sf. 451 - 53. ISBN 0-19-850341-5.
- "Origins of the Element Names: Names Derived from Mythology or Superstition". 21 Ocak 2002 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Aralık 2008.
- "Titanium". Los Alamos National Laboratory. 2004. 21 Kasım 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Aralık 2006.
- van Arkel, A. E. (1925). "Preparation of pure titanium, zirconium, hafnium, and thorium metal". Z. Anorg. Allg. Chem. Cilt 148. ss. 345 - 50.
- Yanko, Eugene (2006). "Submarines: general information". 10 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Aralık 2006.
- Stainless Steel World (Temmuz/Ağustos 2001). "VSMPO Stronger Than Ever" (PDF). KCI Publishing B.V. ss. 16-19. Erişim tarihi: 2 Ocak 2007. Tarih değerini gözden geçirin:
|tarih=(yardım) - NATIONAL MATERIALS ADVISORY BOARD, Commission on Engineering and Technical Systems (CETS), National Research Council (1983). Titanium: Past, Present, and Future. Washington, DC: national Academy Press. ss. R9. NMAB-392.
- "Titanium Metals Corporation. Answers.com. Encyclopedia of Company Histories,". Answers Corporation. 2006. 5 Nisan 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ocak 2007.
- Defense National Stockpile Center (2006). Strategic and Critical Materials Report to the Congress. Operations under the Strategic and Critical Materials Stock Piling Act during the Period October 2004 through September 2005 (PDF). United States Department of Defense. ss. § 3304.
- Bush, Jason (15 Şubat 2006). "Boeing's Plan to Land Aeroflot". BusinessWeek. 9 Nisan 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Aralık 2006.
- "Titanium". Encyclopædia Britannica. 2006. Erişim tarihi: 29 Aralık 2006.
- Matthew J. Donachie, Jr. (1988). TITANIUM: A Technical Guide. Metals Park, OH: ASM International. ss. Appendix J, Table J.2. ISBN 0-87170-309-2.
- Emsley, John (2001). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford: Oxford University Press. ss. 455. ISBN 0-19-850341-5.
- Casillas, N.; Charlebois, S.; Smyrl, W. H.; White, H. S. (1994). "Pitting Corrosion of Titanium". J. Electrochem. Soc. 141 (3). ss. 636 - 42. doi:10.1149/1.2054783. 1 Temmuz 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Aralık 2008. Abstract 1 Temmuz 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Ignasi Puigdomenech, Hydra/Medusa Chemical Equilibrium Database and Plotting Software (2004) KTH Royal Institute of Technology, freely downloadable software at 29 Eylül 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- "Titanium". Microsoft Encarta. 2005. Erişim tarihi: 29 Aralık 2006.
- Cordellier, Serge (2004). L'état du monde 2005: annuaire économique géopolitique mondial. Paris: La Découverte.
- Matthew J. Donachie, Jr. (1988). TITANIUM: A Technical Guide. Metals Park, OH: ASM International. ss. Chapter 4. ISBN 0-87170-309-2.
- Chen, George Zheng (2000). "Direct electrochemical reduction of titanium dioxide to titanium in molten calcium chloride". Nature. Cilt 407. ss. 361 - 64. doi:10.1038/35030069. Abstract
Dış bağlantılar
| Vikisözlük'te titanium ile ilgili tanım bulabilirsiniz. |
| Wikimedia Commons'ta Titanium ile ilgili ortam dosyaları bulunmaktadır. |
- A Cleaner, Cheaper Route to Titanium
- International Titanium Association
- Metallurgy of Titanium and its Alloys, Cambridge University
- World Production of Titanium Concentrates, by Country
- technical information on titanium
- Truth in Sparks: Titanium or Plain Ol' Steel?23 Aralık 2007 tarihinde Wayback Machine sitesinde arşivlendi. Popular Science Magazine

