Atom
Atom veya zerre, bilinen evrendeki tüm maddenin kimyasal ve fiziksel niteliklerini taşıyan en küçük yapı taşıdır. Atom Yunancada bölünemez anlamına gelen atomustan türemiştir. Atomus sözcüğünü ortaya atan ilk kişi MÖ 440'lı yıllarda yaşamış Demokritos'tur. Gözle görülmesi imkânsız, çok küçük bir parçacıktır ve sadece taramalı tünelleme mikroskobu (atomik kuvvet mikroskobu) vb. ile incelenebilir. Bir atomda, çekirdeği saran negatif yüklü bir elektron bulutu vardır. Çekirdek ise pozitif yüklü protonlar ve yüksüz nötronlardan oluşur. Atomdaki proton sayısı elektron sayısına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler.
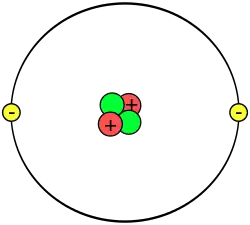
 Helyum atomunun yer aldığı grafikteki pembe kısım çekirdeği, siyah kısım ise elektron bulutunun dağılımı göstermektedir. Sağ üst köşede yer alan çekirdeğin büyütülmüş hâlindeki kırmızı küreler protonları, mor küreler ise nötronları göstermektedir. Çekirdek, gerçekte küresel simetriye sahiptir, ancak daha karmaşık çekirdekler için durum farklıdır. Siyah çizgi, bir ångströmdür (10-10 m ya da 100 pm). | |
| Sınıflandırma | Kimyasal elementlerin bilinen en küçük birimi |
|---|---|
| Kütle | 1.67×10-27 - 4.52×10-25 kg |
| Elektrik yükü | Sıfır (yüksüz) ya da iyon yüklü |
| Yük çapı | 62 pm (He) - 520 pm (Cs) (veri sayfası) |
Bir atom, sahip olduğu proton ve nötron sayısına göre sınıflandırılır: atomdaki proton sayısı kimyasal elementi tanımlarken, nötron sayısı da bu elementin izotopunu tanımlar. Her elementin radyoaktif bozunma veren en az bir izotopu vardır.
Elektronlar belirli enerji seviyelerinde bulunur ve foton salınımı veya emilimi yaparak farklı seviyeler arasında geçişlerde bulunabilirler. Elektron, elementin kimyasal özelliklerini belirlemesinin yanı sıra atomun manyetik özellikleri üzerinde de oldukça etkilidir.
Tarihi
Aristoteles'in maddeye bakışı kendinden önce yaşamış olan filozoflara olan tepkisini ifade eder. O, Empedocles'in düşüncesine katılmış ve her şeyin dört ana maddeden yapıldığını savunmuştur. Bu dört ana madde ateş, su, toprak ve havadır.
Bu zamanı izleyen çağlarda bu düşüncelere bir ilave yapılmadı, ilk kez 1803 yılında John Dalton modern atom kavramını ortaya attı. John Dalton, kimyasal reaksiyonlarda maddenin tam sayılarla belirlenen oranlarda tepkimeye girdiğini gösterdi ve dolayısıyla, maddelerin atom denen sayılabilir ama bölünemez parçalardan oluştuğunu ifade etti. Buna ek olarak, atomların kütlelerini ortaya koyan bir tablo hazırladı.
1869 yılında Rus kimyacı Dmitri Mendeleyev o zaman için bilinen elementleri düzenleyen bir periyodik tablo geliştirdi. J.J. Thomson 1897 yılında elektronu keşfetti. 1911 yılında Ernest Rutherford günümüz atom modelinin temelini teşkil eden yapıyı ortaya koydu: atomun, kütlesinin büyük bir kısmını oluşturan bir çekirdek ve bu çekirdek etrafında dönen elektronlardan oluşmaktadır. Rutherford çekirdeği oluşturan pozitif yüklü parçacığa proton adını verdi.
1932 yılında James Chadwick nötronu (adı, elektrik yükü 0 olduğundan, yani nötr olduğundan, nötron olmuştur.) buldu ve bu sayede 1935'te Nobel Fizik Ödülü'nü aldı. Daha sonra kuantum teorisi doğrultusunda Niels Bohr, Bohr atom modelini ortaya attı ve elektronların belli yörüngelerde bulunabildiğini ve bunun Planck sabiti ile ilgili olduğunu ifade etti. Bohr'un modelinin üzerinde, daha sonraki deneylerde bulunanlarla örtüşmesi için birçok ekleme ve çıkarma yapıldı. Bohr modelinin "yamalı bohça" lakabını alması bundan ileri modelini yapmıştır.
Atomun Yapısal Özellikleri
Niels Bohr'un modeli ise modern atom teorisine en yakın modellerinden biridir. Bohr'a göre elektronlar çekirdeğin çevresinde rastgele yerlerde değil, çekirdekten belirli uzaklıklarda bulunan katmanlarda döner. Bohr da tasarladığı bu modelle Nobel ödülüne de lâyık görülmüştür.
Atomun yapısını açıklayan ve bugün için kabul edilen son teori Kuantum Atom Teorisi'dir. Kuantum Atom Teorisi'ne göre atom modeli Bohr atom modelinden farklıdır. Bohr Atom Modeli'ne göre atomun merkezindeki çekirdeğin etrafında elektronlar çember şeklindeki yörüngelerde dolanmaktadırlar. Her bir çember yörünge belli enerji seviyesine sahiptir. Yörüngeler arası elektronik geçişler atomun renkli görünmesine neden olur. Ancak belli bir zaman sonra Bohr atom modelinin birçok spektrumu açıklayamadığından yetersizliği ortaya çıkmıştır.
Kuantum Atom Modeli'ne göre ise atomun merkezinde bulunan çekirdeğin etrafındaki elektronlar belli bölgelerde yani orbitallerde bulunurlar. Belli enerji seviyelerine sahip orbitaller atomu oluşturan küresel katmanlarda bulunur. Portakal kabuğu şeklinde iç içe geçmiş küresel katmanlardaki orbitallerin belli şekilleri ve açıları(yönelmeleri) mevcuttur. Orbitallerin bulunduğu katmanların enerji seviyelerinin başkuantum sayısı belirler. n = 1,2,3,. . .gibi tam sayılarla ifade edilir. Orbitallerin şeklini ise l yan kuantum sayıları belirler. l = 0(s), 1(p), 2(d),. .(n-1) e kadar değerler alır. Orbitallerin doğrultularını(açılarını) veren ml yan kuantum sayısı ml=-l. . .0. .+l değerlerini alır. Elektronların spini gösteren ms kuantum sayısı da +1/2 veya -1/2 değerlerini alabilir.
Bir atomun çapı, elektron bulutu da dahil olmak üzere yaklaşık cm civarındadır. Atom çekirdeğinin çapı ise cm kadardır. Atomlar, boyutlarının görünür ışığın dalga boyundan çok küçük olması sebebiyle optik mikroskoplarla görüntülenemezler. Atomların pozisyonlarını belirleyebilmek için elektron mikroskobu, x ışını mikroskobu, nükleer manyetik rezonans (NMR) spektroskopisi gibi araç ve yöntemler kullanılır.
Yalnız elektronlar çekirdek çevresinde ancak belirli enerji seviyelerine sahip yörüngelerde dönerler, konumları ancak bir olasılık fonksiyonu ile ifade edilebilir. Elektronlar çekirdeğin etrafında bulutsu bir şekildedir.
Atomaltı parçacıklar
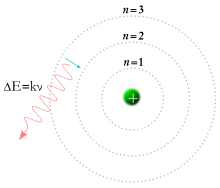
Atom sözcüğü her ne kadar “daha küçük parçacıklara bölünemeyen” gibi bir anlam taşısa da, çağdaş bilimde atom “atomaltı parçacıkların birleşimi” olarak tanımlanır. Atomdaki üç temel parçacık elektron, proton ve nötrondur. Bütün elementlerin atomlarında bu üç parçacık mutlaka bulunur; tek istisnası hidrojen-1 atomudur ki bu atomda nötron yoktur. Ayrıca herhangi bir hidrojen katyonunun elektronu da yoktur. Bundan dolayı hidrojen-1 atomunun katyonuna proton da denir.
Negatif yüklü olan elektron, bu parçacıklar arasında 9.11−31 kg ile en hafif olanıdır. Boyutlarının ölçümü mevcut tekniklerle mümkün değildir. Proton pozitif yüklüdür ve kütlesi, 1.6726−27 kg, yani elektronun kütlesinin 1836 katıdır. Protonun kütlesi, atomdaki bağlanma enerjisine göre değişiklik gösterip azalabilir. Nötron ise yüksüz bir parçacıktır ve kütlesi 1.6929−27kg’dır. Nötron ve protonların boyutları, her ne kadar yüzeyleri tam olarak tanımlanamasa da, birbirlerine yakın değerdedir.
Standart modele göre, proton ve nötronlar kuark adı verilen temel parçacıklardan oluşurlar. Kuarklar bir çeşit fermiyondur ve maddenin iki temel bileşeninden (diğer bileşen leptondur) biridir. Her biri +2/3 veya -1/3 yüklü olan altı çeşit kuark vardır. Protonlar iki yukarı kuark bir tane de aşağı kuarkdan oluşur. Böylece yükü " 2.(+2/3) + 1.(-1/3)= +1 ", yani pozitif olur. Nötronlar ise iki aşağı kuark bir de yukarı kuarktan oluşur ve " 1.(+2/3) + 2.(-1/3) = 0 " sonucu yüksüz olurlar. (Bu hesaplarda +2/3 yukarı kuark, -1/3 ise aşağı kuarkları gösteriyor). Bileşimlerindeki bu farklılık yüklerinin yanı sıra kütlelerinin de değişik olmasına neden olur. Kuarkları, gluonlar aracılığıyla, güçlü çekirdek kuvveti bir arada tutar. Gluon, fiziksel kuvvetleri sağlayan gauge bozonlarından biridir.
Çekirdek
Bir atomdaki bütün Proton ve Nötronlar, atomun boyutuna kıyasla çok küçük bir alana sahip olan çekirdektedir. Proton ve nötronun ikisi birden nükleon olarak adlandırılır. Bir çekirdeğin yarıçapı, toplam nükleon sayısı A olan bir atomda fmdir. Nükleonları "residual strong force" adı verilen kısa menzilli bir çekici güç bir arada tutar. Bu kuvvet 2.5 fmden daha kısa uzaklıklarda, pozitif yüklü protonların birbirlerini itmelerine neden olan elektrostatik güçten çok daha güçlü bir kuvvettir. Bir atomdaki proton sayısına atom numarası denir. Bir elementin bütün atomlarındaki proton sayısı aynıdır. Örneğin demirin atom numarası 26’dır ve dolayısıyla 26 proton bulunduran bütün atomlar demir elementine aittir. Bir elementin atomları arasında nötron sayısı farklılık gösterebilir. Farklı nötron sayılarına sahip aynı element atomlarına izotop denir. Nötron sayısının proton sayısına oranı çekirdeğin kararlılığını belirler.
Nötron ve protonlar farklı fermiyon türleridir. Kuantum mekaniğinin kurallarından Pauli dışarlama ilkesine göre iki benzer fermiyon aynı zaman içinde aynı kuantum durumunda bulunumaz. Yani her proton ve nötron farklı bir yerde bulunmalıdır. Bu yasak, aynı kuantum durumda bulunan bir proton ve nötron için geçerli değildir.
Barındırdığı nötron ve proton sayılarının çok farklı olduğu bir çekirdek, radyoaktif bozunmaya uğrayıp daha düşük bir enerji seviyesine geçerek nötron ve proton sayılarını birbirine yakın değerlere çeker. Birbirine yakın sayıda proton ve nötron içeren çekirdekler radyoaktif bozunmaya karşı daha kararlıdır. Ancak atom numarası arttıkça, protonların birbirlerine uyguladıkları elektrostatik itme kuvvetleri artacağından, protonlar arasına girerek bu itmeleri azaltan nötron sayısı giderek çoğalır. Bunun sonucunda atom numarası 20’nin üzerinde (20, kalsiyumun atom numarasıdır) nötron ve proton sayıları eşit kararlı çekirdekler bulunmaz. Atom numarası arttıkça, kararlı bir çekirdek için gerekli olan nötron/proton oranı 1.5’e doğru kayar.
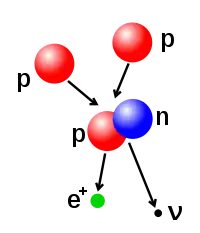
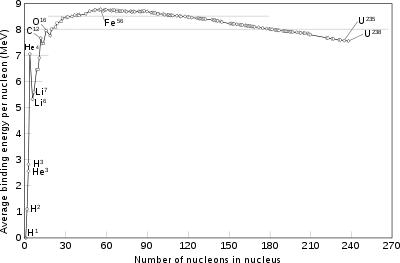
Atom çekirdeğindeki proton ve nötron sayıları değiştirilebilse de bu çok büyük bir enerji gerektirir ve bu olay sonucunda, çekirdeğin değişmesi için emilen enerjiden daha fazla enerji dışarı salınır. Çekirdeğin daha az sayıda nükleon içeren çekirdeklere bölünmesine fizyon denir. Birden fazla çekirdeğin birleşerek daha çok nükleon içeren çekirdeklere dönüşmesine ise nükleer füzyon denir ve füzyonun gerçekleşmesi için gerekli olan enerji, nükleer fizyon için gerekli enerjiden çok daha fazladır. Yine füzyon sonucunda ortaya çıkan enerji, fisyonun ortaya çıkardığı enerjiden de fazladır. Yıldızlardaki muazzam enerji salınımının kaynağı füzyondur. Düşük enerjili yıldızlarda küçük atom numaralı çekirdekler (hidrojen, helyum), yüksek enerjili yıldızlarda ise daha büyük atom numaralı (karbon, oksijen) çekirdekler füzyona uğrar. Yıldızdaki çoğu çekirdek demire dönüştüğünde, demirin füzyonu için gerekli yüksek enerji sağlanamadığından yıldız kütlesine göre bir beyaz cüce, kızıl dev veya kara delik dönüşür.
| Wikimedia Commons'ta atom ile ilgili ortam dosyaları bulunmaktadır. |
