Molekül
Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır.[1] Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucu da oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen.[2] Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.[3]
Moleküler bağlar
Bir molekülün atomları arasında oluşan bağlardır. Moleküller arası bağlardan daha kuvvetlidirler.[4] Bir su molekülünün atomlarını bir arada tutan bağ moleküler bağlara örnektir. Öte yandan su moleküllerini buz halindeyken bir arada tutan bağlar ise moleküller arası bağlara örnektir. Moleküler bağlar kovalent, iyonik ve metalik bağlardır.
_white.png.webp) Su molekülü (H ve O atomları arasındaki bağ moleküler bağa örnektir.)
Su molekülü (H ve O atomları arasındaki bağ moleküler bağa örnektir.)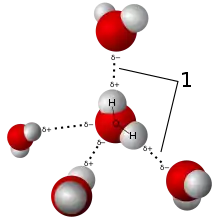 Hidrojen bağı, su molekülleri arasında
Hidrojen bağı, su molekülleri arasında
Kovalent bağlar

İki veya daha fazla atomun elektron paylaşımı sonucu oluşan bağ moleküler bağdır. Bağı oluşturan her bir atom elektron çiftine bir elektron sağlar. Bu bağ eğer iki aynı atomdan oluşmuş ise, oluşturulan bağa apolar kovalent bağ denir. Elektron çifti her iki atoma da eşit uzaklıktadır. Öte yandan bağ eğer iki farklı atom tarafından oluşturulmuş ise oluşturulan bağ polar kovalent bağ olarak adlandırılır. Bu durumda elektronegatifliği daha yüksek olan atomun elektron yoğunluğu negatifliği az olan atoma göre artar.
İyonik bağlar
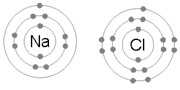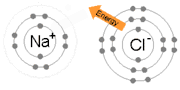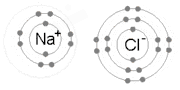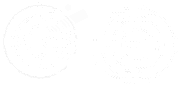
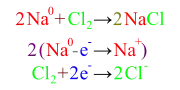
İyonik Bağ, bir ya da daha fazla elektronun bir atomdan ayrılıp başka bir atoma bağlanması süreci sonrasında positif ve negatif iyonların oluşması neticesinde oluşan bağdır.[5] Sodyum ve Klor atomlarından oluşan NaCl'ü oluşturan bağ iyonik bağa tipik bir örnektir.
Metalik bağlar

Metal atomlarını bir arada tutan bağdır. Metal atomların çekirdeğiyle valans elektronları arasındaki etkileşimin kuvveti oldukça zayıftır. Dolayısıyla atomun bu valans elektronlar serbestçe hareket edebilmektedirler. Band teorisine göre metal atomlarını etrafı valans elektronlarının oluşturduğu serbest elektron deniziyle çevrilidir. Bu serbest elektronların paylaşımı sonucu metalik bağ oluşur.
 |
 |
 |
 |
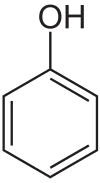
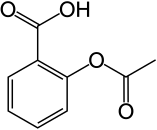
| Su Molekülü | Fenol Molekülü | Aspirin | Fluorescein arsenik heliks bağlayıcı |
Ayrıca bakınız
Kaynakça
| Wikimedia Commons'ta Molecules ile ilgili ortam dosyaları bulunmaktadır. |
- "Molecule". oxforddictionaries.com. 7 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Kasım 2012.
- al.], Ralph H. Petrucci ... [et (2010). General chemistry : principles and modern applications (10th ed. bas.). Toronto: Pearson Prentice Hall. s. 5. ISBN 978-0-13-206452-1.
- "Moleküller ve Katılar" (PDF). anadolu.edu.tr. 7 Mart 2016 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 30 Kasım 2012.
- "İntermolecular bond". chemed.chem.purdue.edu. 26 Ocak 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Kasım 2012.
- "Bonds". hyperphysics.phy-astr.gsu.edu. 20 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Kasım 2012.
