Demir
Demir, simgesi Fe (Latince Ferrum'dan) ve atom numarası 26 olan kimyasal element.

Demir, dünya yüzeyinde en yaygın dördüncü mineral ve yerkabuğunda en çok bulunan metaldir. Yerkürenin merkezindeki sıvı çekirdeğin de tek bir demir kristali olduğu tahmin edilmekle birlikte, demir nikel alaşımı olma ihtimali daha yüksektir. Dünyanın merkezindeki bu kadar yüksek miktardaki yoğun demir kütlesinin dünyanın manyetik alanına etki ettiği düşünülmektedir.
Demir metali, demir cevherlerinden elde edilir ve doğada nadiren elementel halde bulunur. Metalik demir elde etmek için, cevherdeki safsızlıkların kimyasal indirgenme yoluyla uzaklaştırılmaları gerekir. Demir, aslında büyük ölçüde karbonlu bir alaşım olarak kabul edilebilecek olan çelik yapımında kullanılır.
Demir, karbonla birlikte 1420–1470 K sıcaklığa kadar ısıtıldığında oluşan sıvı eriyik %96,5 demir ve %3,5 karbon içeren bir alaşımdır ve dökme demir veya pik olarak adlandırılır. Bu ürün ince detaylı şekiller halinde dökülebilirse de, içerdiği karbonun çoğunu uzaklaştırmak amacıyla dekarbürize edilmediği sürece, işlenebilmek için fazlasıyla kırılgandır.
Kullanım alanları
Demir, tüm metaller içinde en çok kullanılandır ve tüm dünyada üretilen metallerin ağırlıkça %95'ini oluşturur. Düşük fiyatı ve yüksek mukavemet özellikleri demiri, otomotiv, gemi gövdesi yapımı, ve binaların yapısal bileşeni olarak kullanımında vazgeçilmez kılar. Çelik, en çok bilinen demir alaşımı olup, demirin diğer kullanım formları şunlardır:
- Pik demir: %4–%5 karbon ve değişen oranlarda katışkı (S, Si, P gibi) içerir. Demir cevherinden dökme demir ve çeliğe giden yolda bir ara ürün olarak değerlendirilebilir.
- Dökme demir: %2–%4 arasında karbon , %1–%6 silisyum, ve az miktarda manganez içerir. Pik demirde bulunan ve malzeme özelliklerini olumsuz etkileyen, kükürt ve fosfor gibi katışkılar, kabul edilebilir seviyelere düşürülmüştür. 1420–1470 K arasındaki ergime sıcaklığı, her iki bileşeninin ergime sıcaklığından daha düşüktür ve bu özelliği ile demir ve karbon birlikte ısıtılmaları durumunda ilk ergiyen ürün olur. Mekanik özellikleri, büyük ölçüde, bileşiminde bulunan karbonun aldığı forma bağlıdır. 'Beyaz' dökme demirlerde karbon sementit veya demir karbür şeklindedir. Bu sert ve kırılgan bileşik, beyaz dökme demirleri sertleştirir fakat darbelere karşı dayanıksız kılar. Öte yandan, 'gri' dökme demirlerde karbon, serbest ince grafit pulcukları halindedir ve bu da, keskin kenarlı grafit pulcuklarının gerilim arttırma karakterinden dolayı malzemeyi kırılgan yapar. Gri dökme demirin daha yeni bir türü olan 'sünek demir'de ise, malzemenin tokluk ve mukavemetini arttırmak için, dökme demirin az miktarda magnezyum ile muamele edilip grafit pulcuklarının şeklinin küresel veya nodüler hale dönmesi sağlanır.
- Karbon çeliği: %0.4–%1.5 arasında karbon ile az miktarlarda manganez, kükürt, fosfor, ve silisyum içerir.
- Dövülebilir dökme demir: %0.2 den daha az karbon içerir, tok ve dövülebilir bir üründür.
- Alaşımlı çelik: değişen miktarlarda karbonun yanı sıra, krom, vanadyum, molibden, nikel, tungsten gibi diğer metalleri de içerir ve daha çok yapısal alanlarda kullanılır. Demirçelik metalurjisindeki son gelişmeler, çok çeşitli mikroalaşımlandırılmış çeliklerin ('HSLA' veya 'yüksek mukavemet, düşük alaşım' çelikleri) ortaya çıkmasına neden olmuştur. Bu çelik alaşımlarının en büyük özeliği, çok küçük miktarlardaki alaşım elementi ilavesiyle çok yüksek mukavemet ve tokluğun elde edilebilmesidir.
- Demir(III) oksit: bilgisayarlarda manyetik depolama ünitelerinin yapımında kullanılır.
Tarihçe
Demirin ilk kullanımına dair işaretler, mızrak uçları, bıçak ve süs eşyası şeklinde olup Sümerlere ve eski Mısırlılara kadar (yaklaşık MÖ 4000 yılları) dayanmaktadır.
Demirin kolay korozyona uğraması nedeniyle altın ve gümüşten yapılan nesnelere kıyasla çok eski tarihlerde demirden yapılan nesnelere daha az rastlanır. G. A. Wainwright tarafından Giza, Mısır'da bulunan ve MÖ 3500 yıllarına ait olduğu tahmin edilen bazı demir boncukların meteor taşlarından yapıldığı düşünülmektedir. Çünkü, yerkabuğunda bulunan demir yok denecek kadar veya çok çok az bir miktar nikel içermesine karşın, bu boncuklarda meteor kökenli olduklarını belgelercesine % 7,5 oranında nikel içerik tespit edilmiştir.
Daha sonraları MÖ 2000 yıllarında özellikle Mezopotamya ve Anadolu civarında ergitilmiş demirden yapılmış objeler daha çok görülmeye başlanır. Bu objelerin içeriğinde nikele rastlanmaması da meteor taşlarından yapılmadıklarının bir göstergesidir. Ancak bunların kullanımlarının daha çok törensel olması, demirin o çağlarda altından bile daha pahalı olmasından dolayıdır. Örneğin İlyada'da savaş silahları bronzdan yapılmasına karşın demir ingotlar ticarette kullanılmaktadır. Bazı kaynaklara göre o çağlarda demir, bakır'ın saflaştırılması sırasında bir yan ürün olarak ('sünger demir') ortaya çıkmakta ve devrin metalurji bilgisi, demiri yeni baştan üretmeye
MÖ 1600 ile MÖ 1200 yıllarına gelindiğinde demirin Orta Doğu'da giderek artan bir şekilde kullanıldığı görülür, fakat gene de bronzun yerini alamaz.
MÖ 1200 ile MÖ 1000 yıllarında Orta Doğu'da, araç-gereç ve silah yapımında bronzdan demire hızlı bir geçiş yaşanmasının ardında demir işleme teknolojisinde kaydedilen bir gelişme değil, bronz yapımında kullanılan kalayın arzında yaşanan kesinti yatmaktadır. Dünyanın değişik yörelerinde değişik zamanlarda yaşanan bu geçiş süreci, yeni bir çağın, 'Demir Çağı'nın başlangıcının işareti olmuştur.
Bu simge, demirin, silahların metali olduğunu, savaş tanrısı Mars'ı işaret etmekteydi.
Bronzdan demire geçiş süreci sırasında gerçekleşen bir başka keşif de karbürizasyon olmuştur. Karbürizasyonun kelime anlamı demire karbon ilavesi prosesidir. Demir, sünger demir şeklinde kazanılmış ve tekrarlı bir şekilde katlanarak dövülmek suretiyle içerdiği curufun kütleyi terketmesi ve karbonun oksitlenmesi sağlanmıştır. Ancak dövülmüş dökme demirin çok az karbon içermesi nedeniyle su verme ile sertleştirilmesi pek kolay olmamaktaydı. Orta Doğu insanları, dökme demiri, odun kömürü üzerinde uzun süre ısıtıp daha sonra su veya yağda su vererek çok daha sert bir ürün elde etmeyi başarmışlardır. Elde edilen ürün, çeliğin yüzeyine sahipti ve yavaş yavaş yerini almaya başlayacağı bronzdan çok daha sert ve daha az kırılgandı.
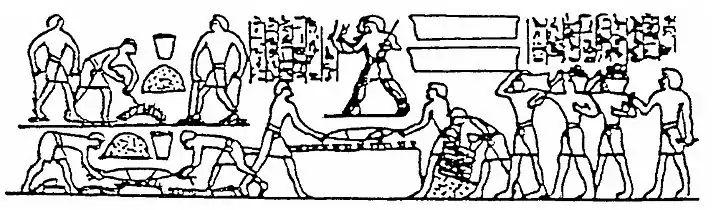
Çin'de Zhou hanedanının son yıllarına doğru (MÖ 550), oldukça gelişmiş ocak teknolojisi nedeniyle yeni bir demir üretim yöntemi ortaya çıktı. 1300 K sıcaklıkları aşan yüksek fırın yapabilmeleri, Çinlilerin dökme demir (veya pik demir) üretmelerini sağladı.
Hindistan'da demirin kullanılışı MÖ 250 yıllarına kadar geri gider. Delhi'de Kutup kompleksindeki ünlü demir direk, saf demirden (%98) yapılmış olup bugüne kadar bozulmadan gelebilmiş ve paslanmamıştır.
Demir, karbonla birlikte 1420–1470K sıcaklığa kadar ısıtıldığında oluşan sıvı ergiyik %96,5 demir ve %3,5 karbon içeren bir alaşımdır. Bu ürün ince detaylı şekiller halinde dökülebilirse de, içerdiği karbonun
çoğunu uzaklaştırmak amacıyla dekarbürize edilmediği sürece, işlenebilmek için fazlasıyla kırılgandır.
Avrupa'da dökme demirin gelişimi, ergitme ünitelerinde 1000K nin üzerine çıkılamadığı için epeyce geç olmuştur. Batı Avrupa'da, orta çağın büyük bir kısmında demir, sünger demirin dövülerek dökme demire dönüştürülmesiyle elde edilmiştir. Dökme demirin Avrupa'da ilk ortaya çıkışı İsveç'in Lapphyttan ve Vinarhyttan bölgelerinde 1150 ve 1350 yıllarında olmuştur. Bu gelişimin Moğollar tarafından Rusya üzerinden bu bölgelere getirildiği şeklindeki hipotezler doğrulanmamıştır. 14. yüzyılın sonlarına doğru, top güllelerine olan talep artışıyla birlikte dökme demir pazarı oluşmaya başlamıştır.
İlk demir izabe (ergitme) işlemlerinde, hem ısı kaynağı hem de redükleme aracı olarak odun kömürü kullanılmıştır. 18. yüzyıl Birleşik Krallık'ında ağaç kaynaklarının azalmasıyla birlikte alternatif olarak kok kömürü kullanılmış ve Abraham Darby'nin bu buluşu endüstri devrimi için gerekli olan enerji kaynağını ortaya çıkarmıştır.
Bulunuşu
Demir uzayda en çok bulunan elementlerden birisi olup yerkabuğunda %5,06 oranında bulunur. Genel olarak yerkabuğunda bulunan demir filizleri (cevherleri) hematit, limonit, götit, magnetit, siderit ve pirittir. Dünyanın çekirdeğinin de büyük oranda metalik demir-nikel alaşımından meydana geldiği tahmin edilmektedir.
 Hematit cevheri
Hematit cevheri Manyetit minerali
Manyetit minerali
Demir cevheri
Demir madenlerinden çıkarılan demir cevherlerini izabeye uygun hale getirmek için yüksek tenörlü ve düşük tenörlü cevherler için yapılan işlemler olmak üzere iki gruba ayrılırlar. Yüksek tenörlü cevherler için sadece boyut küçültme işlemine prosesine tabi tutulurlar. Düşük tenörlü cevherler ise gravite ayırma, manyetik ayırma, flotasyon, elektrostatik ayırma, yıkama, kalsinasyon, liç, seçimli salkımlaştırma gibi yöntemler kullanılarak hazırlanırlar.[1]
Demir ve insan vücudu
Demir, bakır ve kalsiyum gibi bazı minerallerin emilimi ve kanda oksijeni taşıyan kırmızı kan hücrelerinin ve çeşitli enzimlerin üretimi için gereklidir. Ayrıca, bağışıklık sistemini de güçlendirir.
Besin maddeleri ve suda bulunur. Toprakda da bol miktarda demir bileşikleri bulunur. Bitkiler demiri topraktan, hayvan ve insan organizması da bitkilerden alır. Günlük ihtiyaç 8 – 10 mg kadardır. Bu miktar gebelik, emzirme ve adet dönemlerindeki kadınlarda biraz daha fazladır. Demir için en iyi kaynaklar karaciğer, böbrek, kalp, sakatatlar, yumurta sarısı, balık, istiridye, fasulye, ıspanak, buğday ve yulaf unu, hurma, ceviz, fındık, kuru kayısı ve pekmezdir.
Organizmada hemoglobin, miyoglobin, solunum enzimlerinde bulunur. Besinlerde Fe3+ şeklinde bulunur.
- Etlerde porfirin sisteminde kompleks halde
- Sebzelerde anorganik demir halinde
- Hayvan ve insan organizmasında ise iyonlaşan demir halinde bulunur.
Demir eksikliğine, Demir Eksikliği anemisi (kansızlık) denir.
Toksikolojik önlemler
Demirin fazlası insanlar için zehirleyicidir, çünkü aşırı miktarda alınan iki değerli demir (ferros demir) vücuttaki peroksitlerle reaksiyona girerek serbest radikaller yapar.
İnsan vücudu demirin emilimini çok sıkı kontrol eden bir mekanizmaya sahipse de vücuttan atılmasına ilişkin fizyolojik bir yetisi yoktur. Dolayısıyla, alınan aşırı miktardaki demir, sindirim sisteminin tüm bölgelerindeki hücrelere zarar verebilir ve kan dolaşım sistemine girebilir. Kan dolaşımına giren demir, kalp, karaciğer ve diğer organların hücrelerine de zarar vermeye başlar ve bu da, uzun süreli organ hasarları veya aşırı dozdan ölümlere kadar gidebilir.
İnsanlarda demir zehirlenmesinin başlangıç değeri vücut ağırlığının kilogramı başına alınacak 20 miligram demirdir. Kilogram başına 60 miligram demir, öldürücü dozdur.[2] Altı yaşından küçük çocuklarda en çok görülen zehirlenme yoluyla ölüm nedeni, ferros sülfat tabletlerinin aşırı tüketimidir. Vücudun dayanabileceği günlük demir üst sınırı yetişkinlerde 45 miligram, 14 yaş altı çocuklarda ise 40 miligramdır.
Demir eksikliği hastalığı (demir eksikliğine bağlı anemi) olanların haricinde ve bir doktora danışmaksızın demir takviyesi ilaçlarının kullanımı sakıncalıdır. Kan veren kişiler de düşük demir seviyesi riskine sahip olup demir alımlarını takviye etmelidirler.
Demirden ileri gelen toksikasyonlarda spesifik antidot Deferroksamin'dir.
Ferroz (Fe2+) ve ferrik (Fe3+) durumlar arasında kolaylıkla değişim yapabildiğinden dolayı, demir bir redoks sistemi olarak fonksiyon görebilir. Hem demir-sülfür proteinlerindeki non-hem demiri hem de stokromlardaki hem demiri bu yolla kullanılır. Demir aynı zamanda siyanid, karbonmonoksit, moleküler oksijen, ve organik moleküllerdeki azot atomları üzerinde bulunan serbest elektron uçlarına bağlanabilirler. Bu özellik hemoglobin, miyoglobin ve sitokrom oksidaz gibi oksijen bağlayan proteinlerde kullanılır. Aşırı veya yanlış yerlerde bulunduğu zaman demir çok toksiktir: diğer ağır metallerde olduğu gibi demir bazı proteinlere bağlanır, onların yapılarını ve biyolojik özelliklerini bozar. Hatta daha kötüsü, moleküler oksijen varlığında reaktif hidroksil ve oksidatif hasar oluşturmak suretiyle oksidatif hasarı başlatabilir. Bundan dolayı serbest demir konsantrasyonu, yani bağlı olmayan demir minimumda tutulmalıdır. Bu, fizyolojik şartlarda demirle tam olarak doyurulmamış demir bağlayıcı proteinlerle sağlanır. Normal yetişkin bir insanda 3-4 gram demir bulunur.[3]
Kaynakça
- Los Alamos National Laboratory – Demir (İng.)4 Nisan 2004 tarihinde Wayback Machine sitesinde arşivlendi.
- "Yalçın T., Demir Cevherinin Zenginleştirilmesi, İTÜ" (PDF). 2 Aralık 2012 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 30 Ocak 2011.
- "Iron Toxicity". Medscape. 20 Aralık 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Mayıs 2010.
- "Arşivlenmiş kopya". 14 Eylül 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Eylül 2014.
Dış bağlantılar
- Elementel Demir4 Şubat 2006 tarihinde Wayback Machine sitesinde arşivlendi. (İngilizce)
- WebElements.com – Demir18 Ocak 2010 tarihinde Wayback Machine sitesinde arşivlendi. (İngilizce)

