Karbon tetraklorür
Karbon tetraklorür, ayrıca bilinen diğer adlarıyla, IUPAC tarafından tanınan adıyla organik tetraklorometan, (temizlik endüstrisinde karbon tet, yangın söndürmede Halon-104 ve HVACR'de Refrigerant-10,) formülü CCl4 olan organik bileşik. Eskiden soğutucu gazların üretiminde, temizlik maddesi olarak ve yangın söndürücülerde yaygın olarak kullanılmıştır. Düşük seviyelerde tespit edilebilen "tatlı" bir kokuya sahip, renksiz bir sıvıdır. Düşük sıcaklıklarda yanıcılık yoktur.
| Karbon tetraklorür | |
|---|---|
 | |
Tetraklorometan | |
Tetraklorometan | |
Diğer adlar Benziform, Benzinoform, Karbon klorür, Karbon tet, Freon-10, Refrigerant-10, Halon-104, Metan tetraklorür, Metil tetraklorür, Perklorometan, Tetraform, Tetrasol | |
| Tanımlayıcılar | |
| CAS numarası | 56-23-5 |
| PubChem | 5943 |
| EC numarası | 200-262-8 |
| UN numarası | 1846 |
| KEGG | C07561 |
| ChEBI | 27385 |
| RTECS numarası | FG4900000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 5730 |
| Özellikler | |
| Kimyasal formül | CCl4 |
| Molekül kütlesi | 153,82 g mol−1 |
| Görünüm | renksiz sıvı |
| Koku | kloroform gibi |
| Yoğunluk | 1.5867 g cm−3 (sıvı) 1.831 g cm−3 at −186 °C (katı) |
| Erime noktası |
-22.92 |
| Kaynama noktası |
76.72 |
| Çözünürlük (su içinde) | 0.097 g/100 mL (0 °C) 0.081 g/100 mL (25 °C) |
| Çözünürlük () | etanol, dietil eter, kloroform, benzen, nafta, CS2, formik asitte çözünür |
| log P | 2.64 |
| Buhar basıncı | 20 °C'de 11.94 kPa |
| kH | 2.76x10−2 atm-cu m/mol |
| Kırınım dizimi (nD) | 1.4607 |
| Dipol momenti | 0 D |
| Yapı | |
Koordinasyon geometrisi |
Dört açılı |
| Dört yüzlü | |
| Dipol momenti | 0 D |
| Termokimya | |
Standart formasyon entalpisi (ΔfH |
-139.3 kJ/mol |
Gibbs serbest enerjisi (ΔfG˚) |
-686 kJ/mol |
| Tehlikeler | |
| GHS piktogramları |    |
| GHS İşaret sözcüğü | Tehlike |
| NFPA 704 |
 0
3
0
|
| Parlama noktası | <982°C |
| Öztutuşma sıcaklığı |
982°C |
| ABD maruz kalma limiti (PEL) |
TWA 10 ppm C 25 ppm 200 ppm (Herhangi bir 4 saatte 5 dakikalık maksimum tepe)[1] |
| LD50 | 2350 mg/kg |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Tarihi ve sentezi
Karbon tetraklorür, başlangıçta 1839 yılında Fransız kimyager Henri Victor Regnault tarafından Kloroformun klorla reaksiyonuyla sentezlendi.[2] Ama günümüzde esas olarak metandan üretilmektedir:
- CH4 + 4 Cl2 → CCl4 + 4 HCl
Üretimde çoğunlukla diklorometan ve kloroform sentezleri gibi diğer klorlama reaksiyonlarının yan ürünleri kullanılır. Daha yüksek klorokarbonlar da "klorinoliz"e tabi tutulur:
- C2Cl6 + Cl2 → 2 CCl4
1950'lerden önce karbon tetraklorür, karbondisülfürün 105 ile 130 °C'de klorlanmasıyla üretildi:[3]
Karbon tetraklorür üretimi, çevresel kaygılar ve karbon tetraklorürden türetilen CFC'ler için azalmış talep nedeniyle 1980'lerden beri hızla geriledi. 1992'de ABD/Avrupa/Japonya'daki üretim 720.000 ton olarak tahmin edildi.[3]
Özellikler
Karbon tetraklorür molekülünde, dört klor atomu, merkezi bir karbon atomuna tek kovalent bağlarla birleştirilmiş dört yüzlü konfigürasyonda köşeler simetrik olarak konumlandırılır. Bu simetrik geometriden dolayı, CCl4 apolardır. Metan gazı, karbon tetraklorür yapan bir halometanla aynı yapıya sahiptir. Çözücü olarak, diğer polar olmayan bileşikleri ve yağları çözmek için çok uygundur. Ayrıca iyotu da çözebilir. Diğer klorlu çözücülerin karakteristik kokusu ile buharı vererek, biraz uçucu olup, kuru temizleme dükkânlarını anımsatan tetrakloroetilen kokusuna biraz benzer.
Katı tetraklorometan, iki polimorfa sahiptir: −47.5 °C'nin (225.6 K) altındaki kristal II ve −47.5 °C'nin üstündeki kristal I.[4]
−47.3 °C'de, C2/c uzay grubuna ve a = 20.3, b = 11.6, c = 19.9 (.10−1 nm), β = 111° olan örgülü monoklinik kristal yapıya sahiptir.[5] 1'den büyük özgül ağırlığı olan karbon tetraklorür, ortamda yeterli miktarlarda dökülürse yoğun sulu olmayan bir faz sıvısı olarak bulunacaktır.
Kullanımı
Karbon tetraklorür, organik kimyada Appel reaskiyonunda bir klor kaynağı olarak görev yapmaktadır.
Tarihte kullanımı
Montreal Protokolünden önce kloroflorokarbon soğutucuları R-11 (trikloroflorometan) ve R-12'yi (diklorodiflorometan) üretmek için büyük miktarlarda karbon tetraklorür kullanılmıştı. Ancak, bu soğutucular ozon delinmesinde rol oynuyordu. Bu yüzden aşamalı olarak kaldırıldı. Bileşik, hâlen daha az yıkıcı olan soğutucuları üretmek için kullanılmaktadır. Ayrıca nötrinoların bulunmasında da kullanılmıştır.
Çözücü
Karbon tetraklorür, organik kimyada sık kullanılan bir çözücüydü. Ancak sağlık üzerindeki olumsuz etkileri nedeniyle kullanımı kısıtlanmıştır.[6] Önemli bir emici bandı > 1600 cm−1 olmadığından bazen infrared spektroskopi için bir çözücü olarak kullanışlıdır. Hidrojen atomu içermediğinden önceden proton NMR spektroskopisinde kullanılmıştır. Zehirli olmasının yanında çözme gücü de düşüktür.[7] Yerini büyük ölçüde döteryumlu çözücüler almıştır. Petrol tayininde kullanılan çözücülerin yerini ise tetrakloroetilen gibi diğer çözücüler almıştır.[6] Çünkü C-H bağı olmayan karbon tetraklorür, kolayca serbest radikal reaksiyonuna girmez. Elemental halojen veya N-bromosüksinimit gibi halojenleme reaktifleriyle halojenlemeler için kullanışlıdır (Bu koşullar Wohl-Ziegler Brominasyonu olarak bilinir).
Yangın söndürme

1910 yılında Delaware'in Pyrene İmalat Şirketi, yangın söndürmede kullanılması için karbon tetraklorürün patentini aldı.[8] Sıvı, gazlı yangın sindiriminin ilk şekli olarak yanma ısısı ve sönmüş alevlerle buharlaştırıldı. O zamanlar, gazın sadece yangının yakınındaki oksijenin yerini aldığı düşünülüyordu, ama daha sonraki araştırmalarda aslında gazın yanma işleminin kimyasal zincir reaksiyonunu engellediği anlaşıldı.
1911 yılında Pyrene, kimyasal madde kullanan küçük, taşınabilir bir söndürücünün patentini aldı.[9] Söndürücü, ateşe doğru sıvı püskürtmek için kullanılan entegre bir el bombasına sahip pirinçten yapılmış şişeden oluşuyordu. Kap boşaltıldığında, kullanımdan sonra kolayca doldurulabiliyordu.[10] Karbon tetraklorür, elektrik yangınları için uygundu. Söndürücüler genellikle uçak veya motorlu taşıtlarla taşınıyordu.
20. yüzyılın ilk yarısında diğer bir yaygın yangın söndürücü, karbon tetraklorür veya tuzlu su ile doldurulmuş "ateş bombası" olarak bilinen tek kullanımlık, sızdırmaz cam bir küreydi. Ateşi söndürmek için alevlerin altına atılabiliyordu. Karbon tetraklorür doldurulmuş olanlar, ayrıca lehim esaslı sınırlama ile yaylı duvara da monte edilebiliyordu. Lehim, yüksek ısı ile eritildiğinde yay ya küreyi atacak ya da brakete fırlatılarak söndürücü maddenin otomatik olarak ateşe dağılmasına izin verecekti. En çok bilinen marka "Red Comet"ti. Red Comet Manufacturing Company tarafından 1919'da kurulan imalat operasyonları 1980'lerin başında kapatılana dek, Colorado'daki Denver şehrinde çeşitli yangın söndürme ekipmanları ile çeşitli şekilde üretildi.[11]

Diğer kullanımları
Karbon tetraklorür, soğutucu ve lav lambası olarak kullanıldığı gibi yaygın biçimde kuru temizleme çözücüsü olarak da kullanılmaktaydı.[12]
Karbon tetraklorür, özel olarak pul toplarken posta pullarına zarar vermeden filigranları ortaya çıkarmada kullanılıyordu. Küçük bir miktar sıvı, siyah bir cam veya obsidyen tepsi üzerinde oturan bir pulun arkasına yerleştiriliyordu. Daha sonra filigranın harfleri veya tasarımı açıkça görülebiliyordu.
Güvenlik
Karbon tetraklorür, en çok hepatotoksin (karaciğer için zehirli) potansiyeline sahip maddelerdendir. Hepatoprotektif ajanların değerlendirilmesi için bilimsel araştırmalarda yaygın olarak kullanılmaktadır.[6][13] Bileşiğe yüksek derecede maruz kalındığında (buhar olarak) merkezi sinir sistemini etkileyebilir, karaciğer ve böbreklerde dejenerasyona neden olabilir.[13][14] Ayrıca uzun süreli maruz kalındığında komaya veya ölüme yol açabilir.[15] Karbon tetraklorüre kronik olarak maruz kalma karaciğer[16][17] ve böbrek hasarına, hatta kansere yol açabilir.[18]
Karbon tetraklorürün çevre ve insan sağlığı üzerindeki etkileri, madde değerlendirmesi bağlamında 2012 yılında Fransa'da REACH kapsamına değerlendirilmiştir.[19]
2008 yılında ortak temizlik ürünleri üzerine yapılan bir araştırmada, üreticilerin yüzey aktif maddeler veya sodyum hipokloritin (çamaşır suyu) ile sabunun karıştırılması sonucu "çok yüksek konsantrasyonlarda" (101 mg/m³'e kadar) karbon tetraklorüre rastlanmıştır.[20]
Diğer birçok uçucu madde gibi karbon tetraklorür de yanlış kullanım sonucu teneffüs edilebilmektedir. Bunun olası depresan ve/veya merkezi sinir sistemi üzerinde çözülme gibi etkileri vardır. Bu şekilde karbon tetraklorür kullanımı, ciddi sağlık riskleri sunar ve yukarıda açıklanan toksik etkilere neden olabilir.
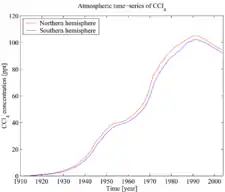
Bileşik, ayrıca ozon tabakasını ve sera gazını tüketmektedir.[21][22] Ancak 1992 yılından beri,[23] yukarıda açıklanan nedenlerle atmosferik konsantrasyonları düşüş göstermektedir. CCl4, 85 yıllık bir atmosferik ömre sahiptir.[24]
Havadaki yüksek sıcaklıklarda zehirli bir gaz olan fosgeni oluşturur.
Kaynakça
- "NIOSH Pocket Guide to Chemical Hazards #0107". National Institute for Occupational Safety and Health (NIOSH).
- V. Regnault (1839) "Sur les chlorures de carbone CCl et CCl2" (On the chlorides of carbon CCl and CCl2 ), Annales de Chimie et de Physique, vol. 70, pages 104-107. Reprinted in German as: V. Regnault (1839). "Ueber die Chlorverbindungen des Kohlenstoffs, C2Cl2 und CCl2". Annalen der Pharmacie. 30 (3). ss. 350-352. doi:10.1002/jlac.18390300310.
- Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Jaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry, 2006 Wiley-VCH, Weinheim.DOI:10.1002/14356007.a06_233.pub2
- "Carbon tetrachloride". 30 Haziran 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2016.
- F. Brezina, J. Mollin, R. Pastorek, Z. Sindelar. Chemicke tabulky anorganickych sloucenin (Chemical tables of inorganic compounds). SNTL, 1986.
- "Use of Ozone Depleting Substances in Laboratories. TemaNord 516/2003" (PDF). 27 Şubat 2008 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 4 Aralık 2016.
- W. Reusch. "Introduction to Nuclear Magnetic Resonance Spectroscopy". Virtual Textbook of Organic Chemistry. Michigan State University. 31 Ağustos 2006 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2016.
- U.S. Patent 1.010.870, Alınma tarihi: 5 Nisan 1910.
- U.S. Patent 1.105.263, Alınma tarihi: 7 Ocak 1911.
- "Pyrene Fire Extinguishers". Vintage Fire Extinguishers. 21 Mayıs 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Aralık 2009.
- "Red Comet Manufacturing Company". City of Littleton, CO. 1 Ekim 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Eylül 2016.
- Doherty RE (2000). "A History of the Production and Use of Carbon Tetrachloride, Tetrachloroethylene, Trichloroethylene and 1,1,1-Trichloroethane in the United States: Part 1—Historical Background; Carbon Tetrachloride and Tetrachloroethylene". Environmental Forensics. 1 (1). ss. 69-81. doi:10.1006/enfo.2000.0010.
- Seifert WF, Bosma A, Brouwer A (Ocak 1994). "Vitamin A deficiency potentiates carbon tetrachloride-induced liver fibrosis in rats". Hepatology. 19 (1). ss. 193-201. doi:10.1002/hep.1840190129. PMID 8276355.
- Liu KX, Kato Y, Yamazaki M, Higuchi O, Nakamura T, Sugiyama Y (Nisan 1993). "Decrease in the hepatic clearance of hepatocyte growth factor in carbon tetrachloride-intoxicated rats". Hepatology. 17 (4). ss. 651-660. doi:10.1002/hep.1840170420. PMID 8477970.
- Recknagel R.O.; Glende E.A.; Dolak J.A.; Waller R.L. (1989). "Mechanism of Carbon-tetrachloride Toxicity". Pharmacology Therapeutics. 43 (43). ss. 139-154. doi:10.1016/0163-7258(89)90050-8.
- Recknagel RO (Haziran 1967). "Carbon tetrachloride hepatotoxicity". Pharmacol. Rev. 19 (2). ss. 145-208. PMID 4859860. 25 Ocak 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2016.
- Masuda Y (Ekim 2006). "[Learning toxicology from carbon tetrachloride-induced hepatotoxicity]". Yakugaku Zasshi (Japonca). 126 (10). ss. 885-899. doi:10.1248/yakushi.126.885. PMID 17016019. 4 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2016.
- Rood AS, McGavran PD, Aanenson JW, Till JE (Ağustos 2001). "Stochastic estimates of exposure and cancer risk from carbon tetrachloride released to the air from the rocky flats plant". Risk Anal. 21 (4). ss. 675-695. doi:10.1111/0272-4332.214143. PMID 11726020.
- "Arşivlenmiş kopya". 20 Ağustos 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Aralık 2016.
- Odabasi M (2008). "Halogenated Volatile Organic Compounds from the Use of Chlorine-Bleach-Containing Household Products". Environmental Science & Technology. 42 (5). ss. 1445-1451. Bibcode:2008EnST...42.1445O. doi:10.1021/es702355u.
- Fraser P. (1997). "Chemistry of stratospheric ozone and ozone depletion". Australian Meteorological Magazine. 46 (3). ss. 185-193.
- Evans WFJ, Puckrin E (1996). "A measurement of the greenhouse radiation associated with carbon tetrachloride (CCl4)". Geophysical Research Letters. 23 (14). ss. 1769-1772. Bibcode:1996GeoRL..23.1769E. doi:10.1029/96GL01258.
- Walker, S. J.; R. F. Weiss; P. K. Salameh (2000). "Reconstructed histories of the annual mean atmospheric mole fractions for the halocarbons CFC-11, CFC-12, CFC-113 and carbon tetrachloride". Journal of Geophysical Research. Cilt 105. ss. 14285-14296. Bibcode:2000JGR...10514285W. doi:10.1029/1999JC900273.
- The Atlas of Climate Change (2006) by Kirstin Dow and Thomas E. Downing ISBN 978-0-520-25558-6
Dış bağlantılar
- "NIOSH Pocket Guide to Chemical Hazards #0107". National Institute for Occupational Safety and Health (NIOSH).
- "Carbon Tetrachloride (Group 2B)". International Agency for Research on Cancer (IARC) – Summaries & Evaluations. Cilt 71. 1999. s. 401.
- IARC Monografi: "Karbon Tetraklorür"
- Karbontetraklorürün toksikolojik profili
- Karbontetraklorürün çevresel sağlık kriterleri
- Tehlikeli Kimyasal Veri Tabanında Karbon Tetraklorür MSDS
- Oxford Üniversitesi'nde MSDS
- ntp.niehs.nih.gov sitesinde madde profili
- ChemSub Online: Karbon tetraklorür21 Temmuz 2011 tarihinde Wayback Machine sitesinde arşivlendi.
