Sodyum hipoklorit
Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir. Sodyum hipokloritin elde edilme formülü aşağıdaki gibidir:
| Sodyum hipoklorit | |
|---|---|
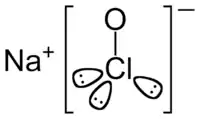 | |
 Sodyum katyonu |
 Hipoklorit anyonunun boşluk doldurma modeli |
Sodyum hipoklorit | |
Diğer adlar Sulandırılmış halde:
| |
| Tanımlayıcılar | |
| CAS numarası | 7681-52-9 |
| PubChem | 23665760 |
| EC numarası | 231-668-3 |
| UN numarası | 1791 |
| KEGG | D01711 |
| ChEBI | 32146 |
| RTECS numarası | NH3486300 |
| ATC kodu | D08 |
| SMILES |
|
| InChI |
|
| ChemSpider | 22756 |
| Özellikler | |
| Molekül formülü | NaClO |
| Molekül kütlesi | 74.442 gr/mol |
| Görünüm | yeşilimsi sarı renkli katı (pentahidrat) |
| Koku | klora benzer ve tatlımsı |
| Yoğunluk | 1.11 gr/cm3 |
| Erime noktası |
18 °C |
| Kaynama noktası |
101 °C |
| Çözünürlük (su içinde) | 29.3 gr/100mL (0 °C) |
| Asitlik (pKa) | >7 |
| Termokimya | |
Standart formasyon entalpisi (ΔfH |
-347.1 kJ/mol |
| Tehlikeler | |
| GHS piktogramları |   |
| GHS İşaret sözcüğü | Tehlike |
| R-ibareleri | R31, R34, R50 |
| G-ibareleri | S1/2, S28, S45, S50, S61 |
| H-ibareleri | H290, H314, H410 |
| P-ibareleri | P260, P273, P280, P301+330+331, P303+361+353, P305+351+338, P310, P501 |
| NFPA 704 |
 0
2
1
|
| Benzeyen bileşikler | |
Diğer anyonlar |
Sodyum klorür Sodyum klorit Sodyum klorat Sodyum perklorat |
Diğer katyonlar |
Lityum hipoklorit Kalsiyum hipoklorit |
Benzeyen bileşikler |
Hipokloröz asit |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Sodyum hipoklorit, kimyasal formülü NaOCl (veya NaClO) olan, sodyum katyonu (Na+) ve hipoklorit anyonundan (OCl- veya ClO-) oluşan kimyasal bileşiktir. Ayrıca hipokloröz asitin sodyum tuzu olarak da bilinmektedir. susuz bileşiği oldukça kararsızdır ve patlayarak yapısı bozulmaktadır[1][2]. Patlayıcı olmayan ve bünyesinde daha yüksek miktarda NaOCl barındırabilen, pentahidrat formunda krsitalleri şeklinde NaOCl.5H2O şeklinde elde edilebilirler [3]. Elde edilen bu bileşik mat sarı-yeşil rengindedir ve soğuk ortamda kararlı olarak saklanabilmektedir[3].
Sodyum hipoklorit en sık kullanılan ağartıcılardan biridir. 18. Yy’dan itibaren, yüzey temizlik kimyasalı olarak evlerde çamaşır sularının en temel katkı malzemesi olarak aktif rol almaktadır. Ayrıca dezenfektan ve ağartma ajanı olarak da geniş kullanım bulmaktadır [4]. Çözelti fazında, bileşik oldukça kararsızdır ve kolaylıkla bozunabilmektedir. Bozunma ürünü, bu tür bileşikler için hemen hemen aynı olan klor gazı çıkışı şeklindedir. Sodyum hipoklorit en eski ve hala en önemli klor-bazlı ağartıcıdır [5].
Korozif özellikleri, ortak kullanım alanları ve tepkime ürünleri, bu kimyasal için risk faktörlerini belirlemektedir[2]. Özellikle, sodyum hipokloritin, asitler veya amonyak gibi diğer temizlik ürünleri ile karıştırılması sonucu zehirli gazların oluştuğu bilinmektedir[6].
Nötrleştirme
Sodyum tiyosülfat, etkili bir klor nötürleştiricisidir. 5 mg/L bir tiyosülfat çözeltisiyle duruladıktan sonra sabun ve suyla yıkamak ellerdeki klor kokusunu kısa sürede uzaklaştırır.
Analiz
Hipoklorit anyonu, iyon kromatografik yöntemlerle, yüksek ayırma gücünde analiz edilebilmektedir. Çözelti içindeki ClO- ve moleküler Cl2 konsantrasyonu (hipokloritin suda çözündüğünde kısmen oluşan yan ürün) iyodometrik titrasyon ile belirlenebilir:
1- Ölçümü yapılmak istenen miktarda sodyum hipoklorit çözeltisi, az miktarda potasyum iyodürün fazlasının olduğu asitlendirilmiş çözelti içine ilave edilir.
2- Açığa çıkan iyot, önceden hazırlanmış standart sodyum tiyosülfat (Na2S2O3) veya fenil arsenik oksit (C6H5AsO) çözeltilerinin nişasta indikatörü olarak kullanılmasıyla sonlandırılır.
(Nişasta-İyot Kompleksi - Mavi Renkli)
(Tepkime sonunda mavi renk kaybolur.)
3- Nişastanın bu çözeltideki mavi renginin kaybolduğu nokta dönüm noktası olarak kaydedilir.
Ayrıca bakınız
Kaynakça
- Hamano, A., The formation and decomposition of sodium hypochlorite anhydrous salt and its pentahydrate. Kayaku Gakkaishi, 1997. 58(4): p. 152-156.
- Urben, P., Bretherick's handbook of reactive chemical hazards. 2017: Elsevier.
- Kirihara, M., et al., Sodium Hypochlorite Pentahydrate Crystals (NaOCl· 5H2O): A Convenient and Environmentally Benign Oxidant for Organic Synthesis. 2017. 21(12): p. 1925-1937.
- Vargel, C., Chapter E.6 - Inorganic Salts, in Corrosion of Aluminium, C. Vargel, Editor. 2004, Elsevier: Amsterdam. p. 417-441.
- OxyChem, Sodium Hypochlorite Handbook. December 2014: p. 25.
- SLAC National Accelerator Laboratory Environment, S., Health, and Quality Division, Sodium Hypochlorite Safe Handling Guideline. National Accelerator Laboratory (SLAC), 20 May 2013(53): p. 3.
Dış bağlantılar
- International Chemical Safety Card 048224 Eylül 2015 tarihinde Wayback Machine sitesinde arşivlendi. (<%10 aktif Cl çözeltileri)
- International Chemical Safety Card 111924 Eylül 2015 tarihinde Wayback Machine sitesinde arşivlendi. ( >10% aktif Cl çözeltileri)
