Sodyum asetat
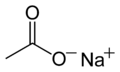
Sodyum asetat (CH3COONa, aynı zamanda NaOAc şeklinde de ifade edilir.[4]), sodyum etonat olarak da bilinen asetik asitin sodyum tuzu. Isınarak sıvılaşabilen bu tuz, geniş bir kullanım alanına sahiptir.
| Sodyum asetat | |
|---|---|
 | |
 | |
Sodyum asetat | |
Sodyum etanat | |
Diğer adlar Sıcak buz (Sodyum asetat trihidrat) | |
| Tanımlayıcılar | |
| CAS numarası | 6131‑90‑4 (trihidrat) 127‑09‑3 6131‑90‑4 (trihidrat) |
| PubChem | 517045 |
| EC numarası | 204-823-8 |
| ChEBI | 32954 |
| RTECS numarası | AJ4300010 (anhidrat) AJ4580000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 29105 |
| Özellikler | |
| Kimyasal formül | C2H3NaO2 |
| Molekül kütlesi | 82,03 g mol−1 |
| Görünüm | Beyaz toz |
| Koku | Bileşienlerine ayrılıncaya kadar ısıtıldığında sirke (asetik asit) kokusuna sahip olur.[1] |
| Yoğunluk | 1.528 g/cm3 (20 °C, anhidrat) 1.45 g/cm3 (20 °C, trihidrat)[2] |
| Erime noktası |
324 °C (615 °F; 597 K) (anhidrat) |
| Kaynama noktası |
881.4 °C (1,618.5 °F; 1,154.5 K) (anhidrat) |
| Çözünürlük (su içinde) | Anhidrat: 119 g/100 mL (0 °C) 123.3 g/100 mL (20 °C) 125.5 g/100 mL (30 °C) 137.2 g/100 mL (60 °C) 162.9 g/100 mL (100 °C) Trihidrat: 32.9 g/100 mL (-10 °C) 36.2 g/100 mL (0 °C) 46.4 g/100 mL (20 °C) 82 g/100 mL (50 °C)[3] |
| Asitlik (pKa) | 24 (20 °C) 4.76 CH3COOH |
| Baziklik (pKb) | 9.25 |
| Tehlikeler | |
| Ana tehlikeler | Tahriş edici |
| NFPA 704 |
 1
1
0
|
| Parlama noktası | >250 °C (482 °F; 523 K) |
| Öztutuşma sıcaklığı |
600 °C (1,112 °F; 873 K) |
| LD50 | 3530 mg/kg (oral, sıçan) |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Reaksiyonlar
Sodyum asetat bromoethan gibi alkil halidler ile birlikte ester oluştumak amacıyla kullanılabilir.
- CH3COONa + BrCH2CH3 → CH3COOCH2CH3 + NaBr
Sezyum tuzları reaksiyonu katalize eder.
Kaynakça
- "Sodium Acetate". International Chemical Safety Cards. National Institute of Occupational Safety and Health. 17 Mayıs 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Nisan 2016.
- "Arşivlenmiş kopya". 25 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Nisan 2016.
- Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand.
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
