Sodyum perklorat
Sodyum perklorat formülü NaClO4 olan bir kimyasal bileşiktir. Perklorik asitin sodyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Sodyum perkloratın çözünürlüğü diğer perklorat tuzları içinde en yüksek olanıdır. Beyaz kristallerden oluşan ve higroskopik özellikte olan sodyum perklorat suda ve alkolde oldukça çok çözünür. Genellikle monohidrat form halinde bulunur ve rombik bir kristal yapısına sahiptir. Standart oluşum entalpisi −382.75 kJ mol−1 dir.[1]
| Sodyum perklorat | |
|---|---|
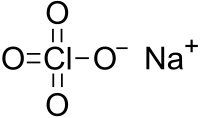 | |
Sodyum perklorat | |
Diğer adlar Sodyum(VII) perklorat Sodyum hiperklorat | |
| Tanımlayıcılar | |
| CAS numarası | 7601-89-0 |
| PubChem | 522606 |
| EC numarası | 231-511-9 |
| UN numarası | 1502 |
| ChEBI | 132103 |
| RTECS numarası | SC9800000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 22668 |
| Özellikler | |
| Molekül formülü | NaClO4 NaClO4.H2O (monohidrat) |
| Molekül kütlesi | 122.44 g mol−1 |
| Görünüm | Beyaz kristal katı |
| Koku | Kokusuz |
| Yoğunluk | 2.4994 g/cm3 2.02 g/cm3 (monohidrat) |
| Erime noktası |
468°C ((bozunur, susuz) |
| Kaynama noktası |
482°C ((bozunur, monohidrat)) |
| Çözünürlük (su içinde) | 209.6 g/100 mL (25 °C, susuz) 209 g/100 mL (15 °C, monohidrat) |
| Tehlikeler | |
| GHS piktogramları |    |
| GHS İşaret sözcüğü | Tehlike |
| NFPA 704 |
 0
2
1
|
| Parlama noktası | 400°C |
| LD50 | 2 - 4 g/kg (tavşan, oral) |
| Benzeyen bileşikler | |
Diğer anyonlar |
Sodyum klorür Sodyum hipoklorit Sodyum klorit Sodyum klorat |
Diğer katyonlar |
Lityum perklorat Potasyum perklorat Amonyum perklorat Sezyum perklorat |
Benzeyen bileşikler |
Perklorik asit |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Kullanımı
Sodyum perklorat diğer birçok perklorat tuzlarının başlangıç hammaddesidir. Diğer perklorat tuzları elde edilirken çoğunlukla NaClO4 (25 °C’de 209 gr./100 ml)’a göre onların düşük çözünürlüğünden faydalanılır. Perklorik asit NaClO4 ile HCl asitinin reaksiyonu ile elde edilir.
NaClO4 higroskopik özelliğinden dolayı piroteknik alanda çok az kullanılır. Daha çok amonyum ve potasyum perkloratlar tercih edilir. Bu tuzlar, sodyum perklorat ve potasyum ya da amonyum klorür çözeltilerinden çifte bozunma yoluyla imal edilirler.
Laboratuvar uygulamaları
NaClO4 laboratuvarda çeşitli kullanım alanlarına sahiptir( çoğunlukla reaktif olmayan elektrolit olarak). Örneğin, moleküler biyoloji alanında standart DNA ekstraksiyon ve melezleştirme reaksiyonlarında kullanılır.
Tıp alanında kullanımı
Sodyum perklorat subklinik hipertiroidizm olan hastalara iyotlu kontrast maddeler verilmeden önce iyot tutulumunu engellemek için kullanılabilir ( Tiroid uyarıcı hormon’u baskı altına alma).[2]
Hayvan eğitiminde kullanımı
Sodyum perklorat ayrıca bomba malzemelerini tespit etmek için köpekleri eğitmek için bir malzeme olarak da kullanılabilir.[3]
Üretimi
Sodyum perklorat sodyum kloratın platin elektrot kullanılarak anodik oksidasyona tutulmasıyla üretilir.[4]
ClO3− + H2O → ClO4− + 2H+ + 2 e− (asidik ortam)
ClO3− + 2 OH− → ClO4− + H2O + 2 e− (alkali ortam)
Ayrıca bakınız
Dış bağlantılar
- WebBook page for NaClO422 Ekim 2008 tarihinde Wayback Machine sitesinde arşivlendi.
Yararlanılan kaynaklar
- "WebBook page for NaClO4". 22 Ekim 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ekim 2012.
- Becker C. [Prophylaxis and treatment of side effects due to iodinated contrast media relevant to radiological practice]. Radiologe. 2007 Sep;47(9):768-73.
- "Explosives Detection Dogs". www.special-dogs.de (Almanca). 22 Nisan 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Temmuz 2017.
- Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone “Chlorine Oxides and Chlorine Oxygen Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. DOI:10.1002/14356007.a06_483
