Potasyum klorat
Potasyum klorat formülü KClO3 olan bir kimyasal bileşiktir. Klorik asitin potasyum tuzu olan bu bileşik diğer kloratlar gibi kuvvetli bir oksitleyicidir.
| Potasyum klorat | |
|---|---|
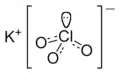 Potasyum kloratın iyon yapısı |
 Potasyum kloratın kristal yapısı |
 | |
Diğer adlar Potasyum (V) klorat | |
| Tanımlayıcılar | |
| CAS numarası | 3811-04-9 |
| PubChem | 6426889 |
| EC numarası | 223-289-7 |
| UN numarası | 1485 |
| RTECS numarası | FO0350000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 18512 |
| Özellikler | |
| Molekül formülü | KClO3 |
| Molekül kütlesi | 122.55 gr/mol |
| Görünüm | beyaz kristal ya da toz |
| Yoğunluk | 2.32 gr/cm3 |
| Erime noktası |
356 °C |
| Kaynama noktası |
400 °C (bozunur[1]) |
| Çözünürlük (su içinde) | 3.13 gr/100 mL (0 °C) 4.46 gr/100 mL (10 °C) 8.15 gr/100 mL (25 °C) 13.21 gr/100 mL (40 °C) 53.51 gr/100 mL (100 °C) 183 gr/100 g (190 °C) 2930 gr/100 g (330 °C)[2] |
| Çözünürlük () | gliserinde çözünür aseton ve sıvı amonyakda çok az çözünür [1] |
| Çözünürlük (gliserin içinde) | 1 gr/100 g (20 °C)[1] |
| Termokimya | |
Standart formasyon entalpisi (ΔfH |
−391.2 kJ/mol[1][3] |
Gibbs serbest enerjisi (ΔfG˚) |
-289.9 kJ/mol[1] |
| Tehlikeler | |
| GHS piktogramları |    [4] [4] |
| GHS İşaret sözcüğü | Tehlike |
| NFPA 704 |
 2
2
3
OX
|
| Parlama noktası | 400 °C |
| LD50 | 1870 mg/kg (oral, sıçan)[5] |
| Benzeyen bileşikler | |
Diğer anyonlar |
Potasyum bromat Potasyum iyodat |
Diğer katyonlar |
Amonyum klorat Sodyum klorat Baryum klorat |
Benzeyen bileşikler |
Potasyum klorür Potasyum hipoklorit Potasyum klorit Potasyum perklorat |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Potasyum klorat (KClO3) beyaz, kristal halde kimyasal bir maddedir. Havai fişeklerde ve ilaç endüstrisinde de kullanılır. Sodyum klorat (NaClO3)’da aynı potasyum klorat gibi beyaz kristaller halinde (toz şeker görünümünde) bulunur. Tek başlarına patlayıcı özellikleri yoktur, kuvvetli bir oksitleyicidir. Hazırlanan uygun karışımlarda patlayıcı özelliği taşırlar
Kaynakça
- "Arşivlenmiş kopya". 15 Temmuz 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Şubat 2015.
- Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. 10 Mart 2016 tarihinde [Google Books kaynağından]
|url=değerini kontrol edin (yardım) arşivlendi. Erişim tarihi: 29 Mayıs 2014. - Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. s. A22. ISBN 0-618-94690-X.
- "Potassium chlorate". 22 Eylül 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Temmuz 2015.
- "Arşivlenmiş kopya". 15 Temmuz 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Şubat 2015.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
