Aseton
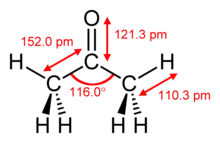
Aseton, propanon ya da dimetil keton, (CH3)2CO formüllü organik kimyasaldır. Keskin, hoş kokulu, yanıcı, zehirli olmayan renksiz bir sıvıdır. Çözücü olarak çokça kullanılır. Sağlığa zararlı değildir. Kapalı formulü C3H6O olarak gösterilir. Kaynama noktası 56 °C'dir.
| Aseton | |
|---|---|
 | |
 | |
 | |
Propan-2-one | |
Propan-2-on | |
Diğer adlar Dimetil keton, propanon, dimetil karbonil | |
| Tanımlayıcılar | |
| CAS numarası | 67-64-1 |
| EC-numarası | 200-662-2 |
| Özellikler | |
| Kimyasal formül | C3H6O |
| Molekül kütlesi | 58,08 g mol−1 |
| Görünüm | renksiz sıvı |
| Koku | tatlımsı, keskin |
| Yoğunluk | 0.78 |
| Erime noktası |
-94.7°C |
| Kaynama noktası |
56°C |
| Tehlikeler | |
| Ana tehlikeler | Yanıcı, tahriş edici |
| NFPA 704 |
 3
1
0
|
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Su, etanol ve eterle her oranda birleşir. Odunun kuru kuruya damıtılmasından, kalsiyum asetatın ısıtılmasından, teknikte izopropil alkolün bakır katalizörlerinden 250 °C'de dehidrojenlenmesinden, etanol ve su buharının 250 °C'de gaz fazında Fe2O3 katalizörlüğünde karışımından elde edilir. Aseton ile sodyum nitrozil prussiat bazik ortamda karıştırılırsa kırmızı çökelme olur, aseton saptanır. Önemli bir tepkimesi bazik ortamda iyotla verdiği iyodoform oluşumudur. Oje çıkarmak için kullanılır. Yağ, kauçuk ve diğer maddelerin çözücüsü olarak kullanılır. Ayrıca boya, izopren, kloroform, bromoform ve iyodoform gibi ürünlerin elde edilişinde öncü madde olarak kullanılır.
Tarih
Aseton ilk olarak Andreas Libavius tarafından 1606'da kurşun(II) asetatın damıtılmasından elde edilmiştir.[1] "Aseton" ismini 1833'te Fransız kimyager Antoine Bussy tarafından verilmiştir.[2] 1852 yılında, İngiliz kimyager Alexander William Williamson asetonun metil asetil olduğunu fark etmiştir.[3]
Üretim
Aseton dolaylı ya da doğrudan propilenden üretilir. Asetonun %83'u kümen yöntemiyle üretilir, sonuçta aseton üretimi fenol üretimine bağlıdır.[4]
Kullanım alanları
Endüstriyel
Aseton kullanımının büyük bir kısmını çözücü olaraktır. Diğer bir kısmı ise endüstride metil metakrilatın üretiminde kullanılan aseton siyanohidrinin üretimidir.
Çözücü
Aseton birçok plastik ve sentetik lif için uygun bir çözücüdür. Poliester reçinelerin inceltilmesinde, henüz donmamış epoksi ve yapıştırıcıların çözülmesinde kullanılır. Boyalar ve verniklerde kullanılan uçucu çözücülerden biridir.
Asetilen taşıyıcısı
Aseton, kendisi yanıcı olmasına karşın, saf hâlde basınçlı olarak saklanamayan asetilenin taşınmasında çözücü olarak kullanılır.
Güvenlik
Yanıcılık
Aseton aşırı derecede yanıcıdır. Asetonun parlama noktası olan -20 °C'den fazla derecelerde %2.5-12.8 havada aseton konsantrasyonları patlayabilir. Aseton buharları yanıcıdır. Statik elektrikten aseton yanması nadiren gerçekleşir. Kızgın kömüre aseton dökülmesi asetonu yakmaz, çünkü asetonun buharlaşırken verdiği serinlik kömürü söndürür.[5] Aseton 456 °C'de kendiliğinden alev alır. Aseton bazlı oje çıkarıcılardaki su miktarından dolayı saf asetondan daha az yanıcıdır.
Aseton peroksit
Asetonun hidrojen peroksit gibi oksitleyicilerle oksitlenmesi sonucu çok güçlü bir patlayıcı olan aseton peroksit oluşur. Kazara aseton ile hidrojen peroksit karıştırıldığında oluşabilir.
Toksisite
Asetonun toksisitesi üzerine çok sayıda çalışmalar yapılmıştır. Solunduğunda ya da yutulduğunda düşük akut ve kronik toksisite göstermektedir.[6] Asetonun kanserojen, mutajen ya da norötoksik etkisi bulunmamaktadır.[5] Aseton tahriş edicidir, bu yüzden aseton buharları çok solunmamalıdır.
Kaynakça
- Bussy, Antoine (1833) "De quelques Produits nouveaux obtenus par l’action des Alcalis sur les Corps gras à une haute température" (On some new products obtained by the action of alkalies on fatty substances at a high temperature), Annales de Chimie et de Physique, 2nd series, 53 : 398–412; see footnote on pp. 408–409.
- Williamson, A. W. (1852) "On Etherification," Journal of the Chemical Society, 4 : 229–239; (especially pp. 237–239).
- Stylianos Sifniades, Alan B. Levy, "Acetone" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- Acetone MSDS. Hazard.com (1998-04-21). Retrieved on 2012-11-26.
- "SIDS Initial Assessment Report: Acetone" (PDF). Environmental Protection Agency. 9 Mart 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 11 Eylül 2014.

