Kloroform
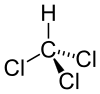
Kloroform, ya da triklorometan, CHCl3 formülüne sahip organik bileşiktir. Renksiz, ağır, hoş kokulu ve suda karışmayan bir sıvıdır. PTFE ve bazı soğutucuların üretiminde kullanılmak için fazla miktarlarda üretilir [1]. Solunduğunda ya da yutulduğunda güçlü birer anestezik ve sedatiftir [2][3].
| Kloroform | |
|---|---|
 | |
 | |
 | |
Trichloromethane | |
Triklorometan | |
Diğer adlar formil triklorür; metan triklorür; metil triklorür; metenil triklorür; freon 20; refrigerant-20 | |
| Tanımlayıcılar | |
| Kısaltmalar | R-20; UN 1888; TCM |
| CAS numarası | 67-66-3 |
| PubChem | 6212 |
| EC numarası | 200-663-8 |
| KEGG | C13827 |
| ChEBI | 35255 |
| RTECS numarası | FS9100000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 5977 |
| Özellikler | |
| Kimyasal formül | CHCl3 |
| Molekül kütlesi | 119,38 g mol−1 |
| Görünüm | Renksiz sıvı |
| Koku | kuru temizleme dükkânı kokusunu andıran tatlı koku |
| Yoğunluk | 1.564 g/cm³ (-20 °C) 1.489 g/cm³ (25 °C) 1.394 g/cm³ (60 °C) |
| Erime noktası |
−63.5 °C (−82.3 °F; 209.7 K) |
| Kaynama noktası |
61.15 °C (142.07 °F; 334.30 K) (450 °C'de bileşenlerine ayrışır.) |
| Çözünürlük (su içinde) | 1.062 g/100 mL (0 °C) 0.809 g/100 mL (20 °C) 0.732 g/100 mL (60 °C) |
| Çözünürlük () | Benzende çözünür. Dietil eter, yağlar, ligroin, alkol, CCl4 ve CS2 ile karışabilir. |
| Buhar basıncı | 0.62 kPa (-40 °C) 7.89 kPa (0 °C) 25.9 kPa (25 °C) 313 kPa (100 °C) 2.26 MPa (200 °C) |
| kH | 3.67 L·atm/mol (24 °C) |
| Asitlik (pKa) | 15.7 (20 °C) |
| Tehlikeler | |
| R-ibareleri | R22, R38, R40, R48/20/22 |
| NFPA 704 |
 0
2
0
|
| ABD maruz kalma limiti (PEL) |
50 ppm (240 mg/m³) |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Doğal oluşum
Çevreye kloroform salınımı yılda ortalama 660000 tondur [4], ve bunun büyük çoğunluğu doğal kaynaklıdır. Birçok deniz yosunu kloroform üretmektedir, ve bazı mantar türlerinin de toprak kloroform ürettiği düşünülmektedir [5]. Abiyotik prosesin de topraktaki kloroform üretimine katkıda bulunduğu düşünülse de mekanizması hâlâ bilinmemektedir [6].
Kloroform; toprak ve sudan hızlıca buharlaşıp havada fosgen, diklorometan, formil klorür, hidrojen klorür, karbondioksit ve karbonmonoksite bozunur. Kloroformun havadaki yarı ömrü 55 ila 620 gün arasında değişmektedir. Kloroform, sucul organizmalarda biyo-akümüle (birikme) olmaz [7].
Kaynakça
https://pubchem.ncbi.nlm.nih.gov/compound/Chloroform 19 Temmuz 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Şablon:Ullmann
- "Ether and Chloroform". 24 Mart 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Nisan 2018.
- Ac08468611], [Anonymus (2012). "Chloroform [MAK Value Documentation, 2000]". The MAK-Collection for Occupational Health and Safety. ss. 20-58. doi:10.1002/3527600418.mb6766e0014. ISBN 978-3527600410.
- Gribble, Gordon W. (2004). "Natural Organohalogens: A New Frontier for Medicinal Agents?". Journal of Chemical Education. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. doi:10.1021/ed081p1441.
- Cappelletti, M. (2012). "Microbial degradation of chloroform". Applied Microbiology and Biotechnology. 96 (6): 1395-409. doi:10.1007/s00253-012-4494-1. PMID 23093177.
- Jiao, Yi (2018). "Halocarbon Emissions from a Degraded Forested Wetland in Coastal South Carolina Impacted by Sea Level Rise". ACS Earth and Space Chemistry. 2 (10): 955-967. Bibcode:2018ECS.....2..955J. doi:10.1021/acsearthspacechem.8b00044.
- Chloroform (PDF), CICAD, 58, World Health Organization, 2004, 17 Aralık 2014 tarihinde kaynağından (PDF) arşivlendi
