Halojenleme
Şablon:Üslup2 Halojenleme, alkenler ,klor ve bromla , nükleofillik özelliği göstermeyen çözücüler içerisinde hızla tepkimeye girerler ve dihalojenleri oluştururlar.[1] Bromun katılması daha kolay takip edilebilmektedir. Çünkü kırmızı-kahve rengi olan Brom çözeltisinin rengi ortadan kalkar. Bu yöntem özellikle çift bağların varlığını kanıtlamada kullanılır. Burada Alken doymamış bir molekül olduğu için bromla tepkimeye girerken, Alkanlar ise ortamda radikal bir çözelti olmadığı sürece tepkime vermez. Genel itibarıyla bu tepkimeler ya oda sıcaklığında ya da soğuk bir ortamda inerten Halojen çözeltilerin (CCl4) varlığında uygulanır.
| Alkenlere Halojenlerin Katılması |
 1,2-Diklorbütan |
| Burada Cl2 Bütenin yapısına katılması sonucunda 1,2-Diklorbütan oluşmaktadır. |
 2,3-Diklorbütan |
| Burada Cl2 2-Bütenin yapısına katılması sonucunda 2,3-Diklorbütan oluşmaktadır. |
 1,2-Dibrombütan |
| Burada Br2 Bütenin yapısına katılması sonucunda 1,2-Dibrombütan oluşmaktadır. |
Bromda anti-Addition
Aşağıdaki tabelada Bromun cis- ve trans- Alkene katılmasını görecez. Burada ürünlerin oluşmasındaki sebepler diğer Halojenler içinde kullanılabilir. Burada Bromun steriyo kimyasına bakacaz. Acaba burada alkenin yapısına katılan her iki Brom atomu alkenin aynı tarafına mı ekleniyor (Hidrojenlerin heterojen katalizörlü katılmasındaki gibi) ya da farklı taraflarına mı bağlanıyor. Yapılan araştırmaların sonucunda Bromun alkenler katılmasında her iki Brom atomunun alkenin farklı taraflarına bağlandığını ortaya koymuştur.[2]
| Bromun cis- ve trans-Alkene Katılması (anti-Addition) |
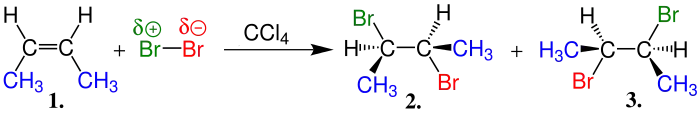 cis-Alkene Bromun katılması |
| Bu arada oluşan ve 1. ve 2. ürünlerin ismi 2,3-Dibrombütan'dır ve rasemik bir yapı oluşturular. |
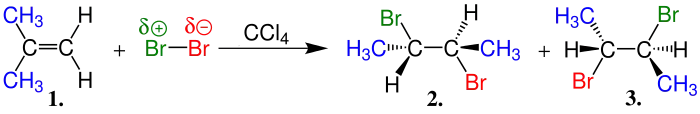 trans-Alkene Bromun katılması |
| Bu arada da oluşan ve 1. ve 2. ürünlerin ismi meso-2,3-Dibrombütan olup her iki üründe aynıdır. |
Bromun anti-Additionundaki Mekanizması
Burada Halojenlerin katılmasını açıklamak için bir İyonik mekanizma önerilmiştir. Burada ilk basamakta Brom molekülüne alkenin π elektronlarının yaklaşması sonucunda brom-brom bağının da bulunan elektronlar alkenden uzakta bulunan diğer brom atomuna doğru iteklenir ve bunun sonucunda brom molekülünde kutuplaşma (polarlaşma) meydana gelir. Polarlaşmanın anlamı alkene yakın bulunan bromun kısmı pozitif yükle yüklenirken alkenden uzaktaki bromsa kısmı bir negatif yükle yüklenmiş olur. Bu kutuplaşma sonucunda brom –brom bağı zayıflar ve sonuçta iki brom iyonu oluşmuş olur. Pozitif brom iyonu alkenle iki elektron çiftiyle bağ oluşturur. Burada kullanılan elektron çiftlerinden ilk çifti alkenin π bağından gelşrken diğer çiftse brom atomunun ortaklaşmamış elektronlarından bir tanesinden gelmektedir. İkinci basamakta ise geride kalan brom iyonu bu halkalı yapı gösteren alkana katılır. Burada katılma ya sağdaki ya da soldaki karbon atomunda gerçekleşir. Negatif yükle yüklü bromun katıldığı karbona bağlı olarak pozitif yükle yüklü brom-karbon bağlarından biri kırılarak halkalı yapı bozulur ve sonuçta trans-alkan oluşur.[3]
| anti-Additionu bromun katılması üzerinden gösteren bir mekanizma. | |
| 1 |
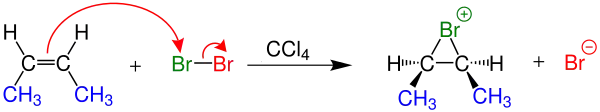 |
| Burada alkene yakın olan Brom atomu alkenin çift bağındaki elektronlar tarafından yapısına katılırken diğer broma ise negatif yükler yüklenir. | |
| 2 |
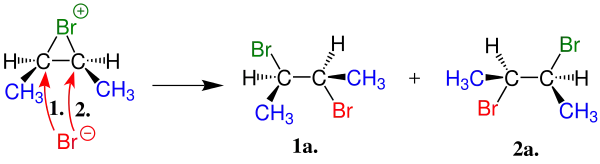 Burada oluşan karbonkatyon iyonu öncekinden kararlı oduğundan bu ürünün oluşması önceliklidir. |
| Bu aşamad ise negatif yükle yüklenin brom atomunu alkene bağlanmasının iki şekli vardır. Bu oluşan iki molekül bir birinin ayna yansıması gibidir. | |
Kaynakça
- T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 334
- K. Peter C. Vollhardt und Neil E. Schore: Organische Chemie 4 . Auflage. Wiley-VCH, 2000, ISBN 3-527-29819-3. Sayfa 574.
- T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 334-335
K. Peter C. Vollhardt und Neil E. Schore: Organische Chemie 4 . Auflage. Wiley-VCH, 2000, ISBN 3-527-29819-3.