Amin (kimya)
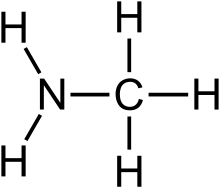
Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş[1] organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik ornatıklarla yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir ( C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M=metal) ile değişmesi halinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.
Alifatik aminler
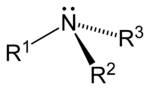
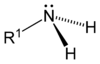
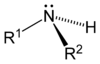
Aşağıdaki şekillerde gösterildiği üzere, amonyaktaki üç hidrojen atomundan biri organik bir ornatık ile yer değişirse bir birincil amin ortaya çıkar. İkincil aminlerde N'ye iki organik ornatık ve bir H bağlıdır. Üçüncül aminlerde üç hidrojenin de yerinde organik gruplar vardır. Bu terimler yerine sırasıyla primer amin, sekonder amin ve tersiyer amin de kullanılır. R gruplarının alttakıları organik ornatıkları birbirinden ayırt etmek için kullanılır (bu amaçla üsttakı kullanımı tercih edilir). Ancak, H atomlarındaki alttakılar o grupta kaç tane H atomu olduğunu belirtir. Bu bileşiklerdeki azot atomu yüklüdür, bunu dengeleyen tersyükünlerin (counterion) varlığı nedeniyle bunlara dördüncül (kuaterner) amonyum tuzları da denir.
| Birincil amin | İkincil amin | Üçüncül amin |
|---|---|---|
 |  |  |
Benzer şekilde, birden fazla amino grubuna sahip olan organik bileşiklere diamin, triamin, tetramin, vb. adlandırılırlar.
Aromatik aminler
Aromatik aminlerde azot atomu bir aromatik halkaya bağlıdır, anilin örneğinde olduğu gibi. Aromatik halka, üzerindeki diğer ornatıklara bağlı olarak, aminin bazlığını büyük oranda azaltır. İlginç bir şekilde, bir amin grubu, elektron verici özelliğinden dolayı, takılı olduğu aromatik halkanın reaktivitesini kuvvetle arttırır. Aromatik aminlerin rol oynadığı bir organik tepkime Goldberg tepkimesidir.
Adlandırma konvansiyonları
- "N-" öneki azot atomunun ornatığını belirtir
- "amino-" öneki
- "-amin" soneki
- Kimyasal bileşiklerin ismi özel isim değildir, dolayısıyla isimde büyük harf kullanılmaz.
Bazı yaygın aminlerin sistematik adları:
| Küçük aminler-amin soneki ile adlandırılırlar. |
Büyük aminlerde fonksiyonel grup olarak amino öneki olur.
|
- Birincil aminler:
- metilamin
- etanolamin veya 2-aminoetanol
- trisamin (veya daha yaygın olarak tris) (bu bileşiğin HCl tuzu biyokimyada bir pH tampon ayıracı olarak kullanılır)
- İkincil aminler:
- dimetilamin
- metiletanolamin ya da 2-(metilamino)etanol
- Halkalı aminler:
- aziridin (3-üyeli halka),
- azetidine (4-üyeli halka),
- pirolidin (5-üyeli halka) ve
- piperidin (6-üyeli halka)
- Üçüncül aminler:
- trimetilamin
- dimetiletanolamin veya 2-(dimetilamino)etanol
- bis-tris (Biyokimyada kullanılan bir pH tampon ayıracı)
Genel özellikler
- Hidrojen bağlanması birincil ve ikincil aminlerin, ayrıca protonlanmış tüm aminlerin özelliklerine önemli ölçüde etki eder. Böylece aminlerin kaynama noktası benzer fosfinlerinkinden daha yüksek ama genelde benzer alkollerinkinden daha düşüktür. Alkoller, veya alkanoller, aminlere benzerler ama NR2 yerine bir -OH grubuna sahiptirler. Oksijen azottan daha elektronegatif olduğundan RO-H kendisine benzeyen R2N-H bileşiğine kıyasla daha asidiktir.
- Metilamin, dimetilamin, trimetilamin ve etilamin standart şartlarda gaz halindedir, oysa dietilamin ve trietilamin sıvıdırlar. Çoğu diğer alkil aminler sıvıdırlar; yüksek molekül ağırlıklı aminler tabiî katıdırlar.
- Gaz aminlerin karakteristik bir amonyak kokusu vardır. Sıvı aminlerin kendilerine has "balığımsı" bir kokuları vardır.
- Çoğu alifatik amin hidrojen bağı kurma yeteneğnden dolayı suda çözünebilir. Karbon atomu sayısı arttıkça çözünrlük azalır, özellikle 6'dan sonra.
- Alifatik aminler organik çözücülerde önemli derecede çözünürlüğe sahiptirler. Birincil aminler ketonlarla (aseton gibi) tepkirler ve çoğu amin kloroform ve karbon tetraklorür ile uyumsuzdur.
- Anilin gibi aromatik aminlerdeki elektron çiftleri benzen halkası ile eşleniklenir, bu yüzden hidrojen bağı kurma yetenekleri azalmıştır.
Kirallik
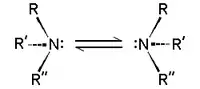
NHR'R ve NRR'R" tipinde aminler kiraldirler: azot grubunun dört ornatığı vardır, tek elektron çifti de sayılırsa. Stereo merkezin evirtiminin enerji engeli nispeten düşüktür, örneğin trialkilamin için ~7 kcal/mol'dür. Stereoizomerlerlerin evirtimi açık bir şemsiyenin rüzgarda tersyüz olmasına benzetilebilir. Bu düşük engel yüzünden NHRR' gibi aminlerin optik izomerleri optik olarak birbirlerinden ayırt edilemezler, NRR'R" tipi moleküller ise ancak R, R', and R" grupları halkalı yapılar içinde sabitlendiklerinde ayırt edilebilirler.
Baz özellikleri
Amonyak gibi aminler de nispeten kuvvetli bazdırlar. Eşlenik (konjuge) asit Ka değerleri için tabloya bakınız). Aminlerin bazlıkları belirleyen faktörler şunlardır:
- Azot üzerindeki yalın elektron çiftinin serbestlik derecesi
- Ornatıkların elektronik özellikleri (alkil gruplar balığı pekiştirir, ariller onu azaltır).
- Protonlaşmış aminin su moleküllerine bağlanma (solvation) derecesi.
Azot atomunda bir yalın elektron çifti bulunur, buna H+ bağlanarak R3NH+ şeklinde bir amonyum iyonu oluşur. Bu metinde yalın elektron çifti N'nin yanında iki nokta olarak gösterilmektedir. Aminlerin suda çözünürlüğü büyük ölçüde su moleküllerindeki protonlar ile bu elektron çiftleri arasında hidrojen bağı oluşmasına bağlıdır.
- Alkil grupların Endüktif etkileri
| Bileşiğin iyonu | Kb |
|---|---|
| Amonyak NH3 | 1.8·10−5 M |
| Metilamin CH3NH2 | 4.4·10−4 M |
| propilamin CH3CH2CH2NH2 | 4.7·10−4 M |
| 2-propilamin (CH3)2CHNH2 | 5.3·10−4 M |
| dietilamin (CH3)2NH | 9.6·10−4 M |
- Alkil grupların endüktif etkisi yalın elektron çiftinin enerjisini yükselterek bazlığını yükselmesine neden olur.
- Aromatik sistemlerin Mezomerik etkisi
| Bileşiğin iyonu | Kb |
|---|---|
| Amonyak NH3 | 1.8·10−5 M |
| Aniline C6H5NH2 | 3.8·10−10 M |
| 4-metilfenylamin 4-CH3C6H4NH2 | 1.2·10−9 M |
- Aromatik halkanın mezomerik etkisi yalın elektron çiftini halkaya doğru yersizleştirerek (delokalize ederek) bazlığını azalmasına neden olur.
- Protonlaşmış aminlerin protonlaşma derecesi:
| bileşiğin iyonu | En çok H-bağı |
|---|---|
| NH4+ | 4 H2O'da çözünürlüğü çok |
| RNH3+ | 3 |
| R2NH2+ | 2 |
| R3NH+ | 1 H2O en az çözünür |
Sentez
Laboratuvarda aminlerin hazırlanması için aşağıdaki yöntemler vardır.
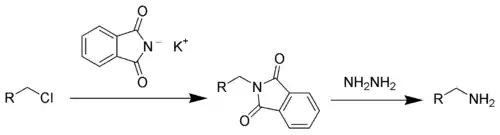
- Gabriel sentezi
- Staudinger indirgemesi ile azid yoluyla
- Alil aminler iminlerden Aza-Baylis-Hillman tepkimesi ile hazırlanabilirler.
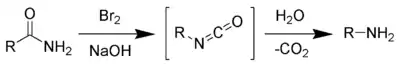
- Amidlerin Hoffman bozulumuyla/ Bu tepk'me yalnizca birincil aminlerin hazırlanması için geçerlidir. Başka aminler karışmadan yüksek randımanlı olarak birincil aminler verir.
- Dördüncül amonyum tuzları kuvvetli bir bazla tepkiyince Hofmann eliminasyonu meydana gelir.
- Nitril, amid ve nitro bileşiklerinin indirgenmesi ile:
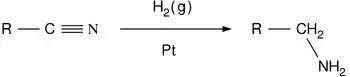
Nitriller nikel katalizör kullanarak aminlere indirgenirler, ama -CN grubunun kaybetmemek için asit veya alkali şartlar kullanılmamalıdır. LiAlH4 laboratuvar ölçeğinde nitrillerin indirgenmesinde daha sık kullanılır. LiAlH4, amidleri aminlere indirger:
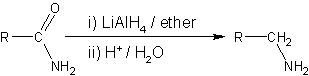
Nitro bileşiklerinin aminlere indirgenmesi için asitle çinko, kalay veya demir kullanılır.
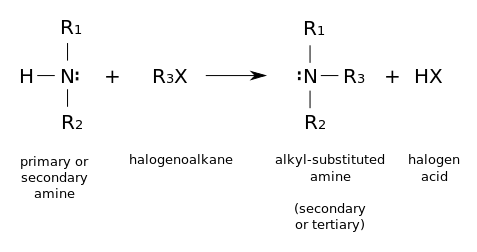
- Haloalkanların nükleofilik ornatımı. Birincil aminler ayrıca amopnyağın alkillenmesi ile sentezlenirler. Haloalkanlar aminlerle tepkiyip alkil-ornatık aminler oluştururlar, bir halojen asit salarak. Bu tepkimeler özellikle alkil iodür ve bromürler için faydalıdır, ama alkillenme derecesini kontrol etmek zor olduğu için ender olarak kullanılırlar. Eğer tepkimeye giren amin üçüncül ise, bir dördüncül amonyum katyonu meydana gelir. Bu yolla pek çok dördüncül amonyum tuzu hazırlanabilir, bunların çeşitli R grupları ve pek çok halojenür ve psödohalojenür anyonu olabilir.
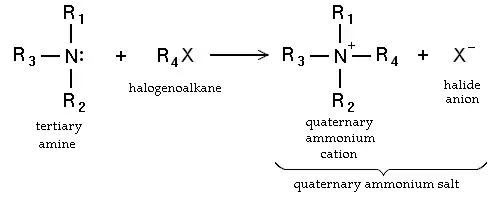
- Delepine tepkimesi ile, halojenürler ve heksaminden.
- Aril aminler aminler ve aril halojenürlerden Buchwald-Hartwig tepkimesi ile elde edilebilir.
Tepkimeler
Aminler çeşitli yollarla tepkirler:
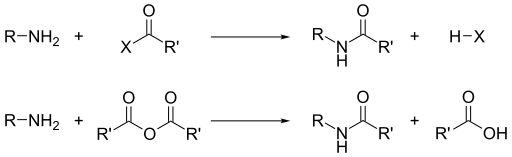
- Nükleofilik asil ornatımı ile. Asil klorürler ve asit anhidrürler birincil ve ikincil aminlerle soğukta tepkiyerek amidler oluştururlar. Üçüncül aminler yer değişebilecek bir hidrojene sahip olmadıklarından asillenemezler. Çok daha az etkin olan Benzoyl klorür durumunda asilleşme tepkimesini kolaylaştırmak için alkali kullanılır.
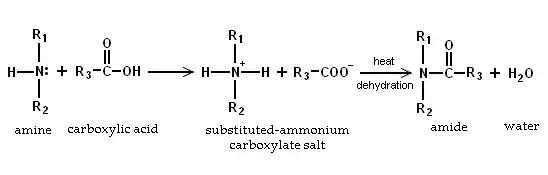
- Aminler bazik oldukları için karboksilik asitleri nötürleştirip amonyum karboksilat tuzları oluştururlar. 200 °C'de ısıtılınca birincil ve ikincil tuzlar su kaybedip amidlere dönüşürler.
- Amonyum tuzu oluşmasıyla. Üçüncül aminler (R3N) hidroiyodik asit, hidroklorik asit veya hidrobromik asit gibi kuvvetli asitlerle nötürleşme tepkimelerine girip R3NH+ amonyum tuzları oluşturular.
- Diazonyum tuzu oluşumu ile. Nitröz asit (HNO2) çok kararsız olduğu için onu dolaylı olarak üretmek için NaNO2 ve deriçik hidroklorik asit veya sülfürik asit kullanılır. Nitröz asit ile birincil alifatik aminler tepkiyince çok kararsız olan diazonium tuzları oluştururlar bunlar da N2 kaybederek kendiliklerinden yılıma uğrayarak karbonyum iyonuna dönüşürler. Karbonyum iyonu başlıca alkanollar olmak üzere alken, alkanol ve alkil halojenürlerden oluşan bir karışım oluşturur. Bu tepkime sentez için önemli değildir çünkü oluşan diazonyum tuzu soğuk çözeltilerde dahi çok kararsızdır.
- NaNO2 + HCl → HNO2 + NaCl
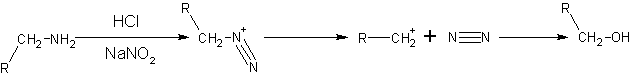
- Birincil aromatik aminler, örneğin anilin (fenilamin), 0–5 °C'de daha kararlı diazonyum iyonları oluştururlar. 5 °C üstünde yıkıma uğrayıp fenol ve N22ye dönüşürler. Arendiazonyum tuzları kristal halde izole edileiblirler ama genelde hazırlandıktan sonra hemen çüzeltide kullanılırlar, hızla yıkıma uğradıkları için. Katı arendiazonyum tuzları sadmeyle veya ısınmayla patlayabilirler. Arendiazonyum tuzları alifatik benzerlerine kıyasla daha kararlı oldukları için sentez tepkimelerinde daha faydalıdırlar. Diazonyum tuzunun saflaştırılması gerekli olmadığından oluştuktan sonra başka bir tepkin, örneğin bakır siyanür, karışıma eklenebilir ve çözeltinin hafif ısıtılmasıyla azot gazının salındığı bir değişim tepkimesi gerçekleşir. Ayrıca, arendiazonyum iyonları, fenol gibi etkinleştirilmiş bir aromatik bileşik ile birleşerek azo bileşikleri olulşturabilir.
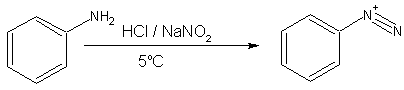
- İmin oluşumu ile. Birincil aminler keton ve aldehitlerle tepkiyip iminler oluştururlar. Formaldehit durumunda (R' = H), bu ürünler halkalı trimerler olur.
- RNH2 + R'2C=O → R'2C=NR + H2O
- ikincil aminler keton ve aldehitlerlertepkiyip enaminler oluşturur.
- R2NH + R'(R"CH2)C=O → R"CH=C(NR2)R' + H2O
- Aminler yükseltgenerek nitroso bileşikleri oluştururlar, örneğin peroksimonosülfürik asit ile tepkiyerek.
- Emde bozunumunda dördüncül amonyum iyonları üçüncül aminlere indirgenirler.
- Hofmann-Martius düzenlenmesinde N-alkil anilinler aril ornatıklanmış anilinlere dönüşürler.
- Zincke tepkimesinde birincil ve ikincil aminler piridinium tuzları ile tepkir.
Biyolojik etkileri
Amınlerin kendilerine has, kuvvetli, kötü kokuları vardır ve toksiktirler. Amonyak, balık, idrar , çürüyen et ve sperm kokuları aminlerden oluşur. Pek çok biyolojik etkinlik amino asitlerin parçalanması sonucu aminler oluşturur.
Boyalar
Birincil aromatik aminler azo boyalarının yapımı için başlangıç malzemesi olarak kullanılır. Nitrik (III) asit ile tepkiyip diazonyum tuzları oluşturur, bu da birleşme tepkimesi sonucunda azo bileşiği oluşturur. Azo bileşikleri renkli olduklarından boya endüstrisinde yaygın olarak kullanılırlar. Bu maddelere bazı örnekler:
- Metil turuncu
- Gün batımı sarısı
- Ponceau kırmızısı
İlaçlar
- Klorfeniramin bir antihistamindir, soğuk algınlığı, saman nezlesi, böcek sokması gibi durumlar için kullanılır.
- Klorpromazin bir sakinleştiricidir. Anksiete, heyecan, yerinde durama ve hatta akıl hastalıklarında kullanılır.
- Amfetamin, metamfetamin illegal ilaçlardır.
Gaz arıtımı
- Suda çözünmüş monoetanolamin, diglikolamin, dietanolamin, diisopropanolamin ve metildietamolamin endüstride yaygın olarak kullanılırlar, doğal gaz hatlarından ve rafineri artıklarından karbon dioksit ve hidrojen sülfür gazlarını arıtmak için. Ayrıca bacalardan CO2'nin arıtılması için de kullanılabilirler ve sera etkisinin önüne geçme potansiyelleri vardır.
Ayrıca bakınız
- Aminlerin adlandırılması için IUPAC organik kimya adlandırma sistemi
- Biyolojik kökenli aminler
Kaynakça
- "amine." Oxford Dictionary of English 2e, Oxford University Press, 2003.