Yapısal biyoloji
Yapısal biyoloji, biyolojinin özellikle amino asitlerden yapılmış olan proteinler, nükleotitlerden yapılmış RNA ve DNA gibi nükleik asitler ve lipitlerden oluşmuş membranlar olmak üzere biyolojik makromoleküllerin yapılarını ve uzamsal dizilişlerini inceleyen bir dalıdır.[2] Yapısal biyoloji asıl olarak biyofizik yöntemleri ile makromoleküllerin atom düzeyinde üç boyutlu yapılarının belirlenmesi, yapısal değişikliklerinin temel prensipleri, moleküler hareketlerin analizi ve bu yapıların dinamiği ile ilgilenir. Makromoleküller hücrelerin hemen hemen tüm işlevlerini yerine getirir ve bunu da yapabilmek için belirli üç boyutlu şekillere girerler. Moleküllerin "üçüncül yapı"sı olarak adlandırılan bu yapılar her molekülün temel bileşimi ya da "birincil yapı"ları ile karmaşık bir şekilde bağlantılıdır.
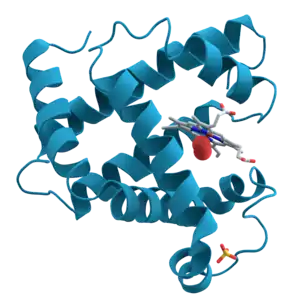
Biyomoleküller en gelişmiş ışık mikroskopları ile bile detaylı olarak görülemeyecek kadar küçüktür. Yapısal biyologların biyomoleküllerin yapısını belirlemek için kullandığı yöntemler genellikle çok sayıda özdeş molekülün aynı anda ölçülmesini içerir. Bu yöntemler arasında kütle spektrometrisi, makromoleküler kristalografi, nötron kırınımı, proteoliz, biyomoleküler nükleer manyetik rezonans spektroskopisi (NMR), elektron paramanyetik rezonans (EPR), kriyo-elektron mikroskobu, elektron kristalografisi ve mikrokristal elektron kırınımı, çok açılı ışık saçınımı, biyolojik küçük açılı saçınım, ultra hızlı lazer spektroskopisi, ikili polarizasyon interferometresi ve dairesel dikroizm sayılabilir. Çoğunlukla araştırmacılar bu yöntemleri makromoleküllerin "doğal durum"larını incelemek için kullanırlar. Ama aynı zamanda bu yöntemlerin bazı varyasyonları açığa çıkmış ya da denatüre moleküllerin doğarl durumlarına gelmesini izlemek için de kullanılır.
Yapısal biyologların moleküler yapıları anlamak için kullandıkları bir başka yöntem de belirli şekillerin ortaya çıkmasına neden olan çeşitli dizilimlerin arasında modelleri aramak için kullanılan biyoenformatiktir. Araştırmacılar sıklıkla hidrofobisite analizi ile tahmin edilen membran topolojisi temel alınarak integral membran proteinlerinin yapısal özelliklerini çıkarabilirler.
Son yıllarda biyolojik yapıların in silico araştırmalarını tamamlayacak oldukça hassas fiziksel moleküler modeller de mümkün olabilmiştir ve bu modellere örnekler Protein Veri Bankası'nda bulunabilir.
Proteinlerin yapılarını, şekil değiştirmelerini ve işlevlerini araştırmak için ampirik yapı belirleme yöntemlerinin yanı sıra moleküler dinamik simülasyonları gibi işlemsel teknikler de kullanılabilmektedir.[3]
Yapısal biyoloji araştırmalarının sonuçlarından sıklıkla ilaç geliştirme projelerinde yararlanılır. Bir ilacın hedefi üzerindeki etkisinin moleküler ve yapısal olarak anlaşılması ve bunun görselleştirilmesi aktif moleküllerin tasarımını ve iyileştirilmesini mümkün kılar. Bunu sağlamak için hem yapısal analizi inceleyen deneysel yöntemler hem de bilişimsel yaklaşımlar kullanılarak moleküler yapılarından yola çıkarak aday ilaçlar belirlenir.
Yapısal biyoloji teknikleri
Optik mikroskop tekniği biyolojik moleküllerin atomik yapısını görmek için yeterli çözünürlüğe sahip değildir. Yapısal biyolojide kullanılan yöntemler daha sıklıkla dolaylı fiziksel yöntemlerdir. Tarihsel olarak en eski ve günümüzde de en çok kullanılan yöntem X ışını kristalografisidir. Bu yöntemi tamamlamak için hem atomik ölçekte çözünürlüğe ulaşmak hem de çözelti içindeki moleküllerin dinamiğini anlamak için nükleer manyetik rezonans spektroskopisi(NMR) kullanılır. Biyolojik küçük açılı saçınım ve nötron kırınımı gibi kullanılan diğer yöntemler yüksek çözünürlüklü değildir ancak çözelti içindeki molekülleri incelemek için diğer yöntemlerin gerektirdiği kırınım yapabilen monokristallerin oluşturmasını gerektirmediği ve NMRîn ihtiyaç duyduğu küçük örneklemelere ihtiyaç duymadığı için kullanışlıdır.
Yeni sensörler[4] ve veri işlemedeki gelişmeler sayesinde kriyo-elektron mikroskobu rutin olarak elde edilen çözünürlüğü oldukça önemli oranda geliştirmiştir.[5]. Kristalografi ve NMR'in sınırlamalarına sahip olmayan kriyo-elektron mikroskobu büyük boyutlu makromoleküllerin incelenmesinde ana yöntem olarak yapısal biyolojide diğer iki yöntemin yerine geçmektedir.
Makromoleküler kristalografi
Kristalografik yapının çözünürlüğü X ışınlarının makromolekül kristallkeri üzerindeki kırınımlarının incelenmesne dayanır. Elektronlera çarpan X ışınları kırınıma uğrar ve molekülün elektron yoğunluğunu yani molekülün çevresinde dönen elektronlerın yerini bulmak için analiz edilebilir. Bu yoğunluk yeteri kadar belirgin ise molekülün her bir atomunun yerini tespit etmeye yani kartezyen koordinatlarını belirlemeye yarar.
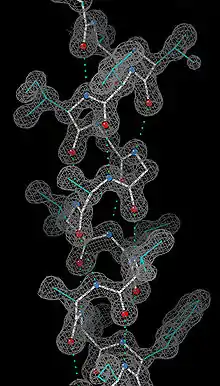
Bu analiz yönteminin ön koşul moleküllerin kristallerinin elde edilmesidir. Uygun fiziksel ve kimyasal koşullar altında çözelti içindeki makromoleküller kristaller oluşturabilir. Bir molekülden diğerine değişkenlik gösteren bu uygun fiziksel ve kimyasal koşulların saptanması çoğunlukla ampiriktir. Ayrıca molekülün saflık derecesi de belirleyici faktörlerden biridir. Dolayısıyla ön koşul olan kristalleşme etabı bu tür analiz için genellikle sınırlayıcı olmaktadır.
Onlarca ya da yüzlerce mikron büyüklüğünde yeterli kristal boyutuna erişildiğinde monokromatik X ışını hüzmesi altına getirilir. Uygun koşullar altında kristal yapı içinde dizilmiş elektronlara çarpan X ışınları krınıma uğrar. Bir sensör yardımıyla, kristalin farklı oryantasyonları için kırınım desenleri kaydedilir. Desen üzerindeki lekelerin arasındaki boşluk kristal yapı hakkında bilgi verir. Lekelerin şiddeti de kristal yapı içindeki her bir makromolekülün elektron yoğunluğu hakkında bilginin bir kısmını sağlar. Her bir leke ile bağlantılı sinyal fazı ise kaybolduğundan yeniden oluşturulmalıdır. Bu fazları oluşturmak için farklı yöntemler kullanılır:
- Çoklu izomorf replasmanı kristal içine elektron zengini olan ağır atomları yaymak ve kristalin kırınımını ağır atomlar ile ve ağır atomlar olmadan kıyaslamaktır. Ağır elementlerin varlığı kırınım şiddetini hafifçe değiştirdiği için veri üçlemesi yoluyla fazları hesaplamak mümkün olabilmektedir;
- Anormal saçılma molekülün içinde yer alan atomlardan bir türünün soğurma eşiği çevresinde X ışınlarının boyunu değiştirme yöntemidir. Özellikle kullanılan dalga boylarına (0,1 nm) yakın bir soğurma eşiğine sahip olan selenyum sıklıkla kullanılır. Proteinler için genellikle biyosentetik yoluyla sokulan selenosistein ya da selenometiyonin gibi amino asitler kullanılır;
- Moleküler replasman ise bilindiği takdirde eşlenik bir protein yapısının kullanılması yöntemidir. Eşlenik yapı kristalin içine sokulmaya çalışıldıktan sonra teorik kırınımı hesaplanır ve gözlemlenen kırınım ile kıyaslanır. Bu şekilde teorik öncül fazlar hesaplanabilir.;
Bir kere fazlar hesaplandıktan sonra kırınım sinyallerinin Fourier dönüşümü ile elektron yoğunluğu elde edilir. Böylece molekülün her bir atomunun kartezyen koordinatlarını elde etmeye olanak sağlayan otomatik sistemler ya da interaktif grafik yazılımları kullanılarak elektron yoğunluğu yoluyla molekül yeniden oluşturulmaya çalışılır. Model oluşturulduktan sonra kırınım şiddetleri teorik olarak bu modele göre hesaplanır ve deneysel olarak elde edilen şiddet değerleri ile kıyaslanır. Böylece aşamalı olarak model geliştirilir.
Biyomoleküler nükleer manyetik rezonans spektroskopisi
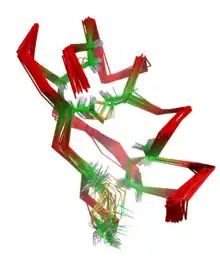
Nükleer manyetik rezonans ya da NMR molekül üzerine uzaklık ve açı gibi geometrik bilgileri elde etmek için atom çekirdeklerinin manyetik özelliklerini kullanır. Elde edilen bu geometrik bilgilerle bir çeşit veri üçlemesi yöntemi kullanılarak molekülün üç boyutlu yapısını hesaplamak mümkündür.
Özellikle hidrojen 1H, karbon 13C ve azot 15N gibi belirli atomların çekirdekleri spin adı verilen açısal momentuma sahiptir. Bu spin bi manyetik dipol momenti ile bağlantılıdır. Tipik olarak 10 ila 20 Tesla büyüklüğünde çok şiddetli bir manyetik alana yerleştirildiklerinde bu spinler manyetik alan ile aynı doğrultuya gelir. NMR, moleküldeki spinler arasındaki etkileşimleri inceler ve asıl olarak iki türlü etkinin gözlemlenmesine olanak verir. Birincisi elektron çiftleri arasındaki bağlarda görülen skaler etkileşimlerdir. Bu skaler etkileşimler molekülün kovalent bağları ile oluşan birleşimleri belirlemeye olanak sağlar ve böylece molekülün topolojisi çıkarılabilir. Topoloji bu bağların geometrisine ve özellikle de atomlar arasındaki ikidüzlemli açılara bağlıdır. İkincisi nükleer Overhauser etkisi adı verilen ve uzam içinde manyetizasyon transferine karşılık gelen dipolar etkileşimlerdir. Bu etkileşimler yalnızca atomlar arasındaki uzaklıklara bağlıdır ve atomlar arasındaki bağların geometrisinden bağımsızdır. Ayrıca yalnızca 0,5 nm civarında iseler gözlemlenebilirler.
Biyomoleküler nükleer manyetik rezonans spektroskopisi çözelti içindeki makromolekülleri örnek olarak kullanır ve alınan spektrografilerle hem skaler hem de dipolar etkiler arasındaki ilişkileri kaydeder. Alınan spektrografilerden farklı sinyallerin analizinin gerçekleştirilmesiyle molekülün her bir atomu birer birer belirlenebilir. Bundan sonra molekülün geometrik verileri toplanır ve alınan spektroskopi sonuçları ile birleştirilerek molekülün üç boyutlu yapısı hesaplanır.[6]. Bu hesaplamalar iterasyon yöntemi ile tek bir çözüme ulaşılana kadar devam eder.
Kriyo-elektron mikroskobu
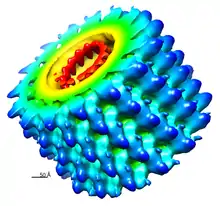
Kriyo-elektron mikroskobu karmaşık makromoleküllerin yapılarının düşük çözünürlüklü görüntülerini elde etmeye yarar. İncelenek olan makromolekül sıvı azot banyosu içinde tutulan sıvı etan gibi kriyojenik bir sıvının içine hızlıca batırılıp çıkarılarak dondurulur. Bu koşullar altında çözelti içindeki su, içindeki makromoleküllerin biçimlerini koruyacak şekilde amorf hâlde katılaşır.
Bu aşamadan sonra elektron mikroskobuyla buz içinde katılaşan molekülün farklı oryantasyonlarda resmi elde edilir. Bilişim yöntemleri ile bu farklı resimler sınıflandırılarak benzer bir oryantasyonda incelenen biyolojik nesnelerle karşılaştırılarak gruplandırılır. Gruplana bu resimlerin her birinde arkaplan gürültüsünün azaltılması için resim çözümleme teknikleri uygulanır.
Bu veri işleme sonrasında, incelenen üç boyutlu yapının dikey izdüşümlerine karşılık gelen hassas iki boyutlu resimler elde edilir. Yeniden bilişim yöntemleri kullanılarak bu iki boyutlu resimlerden molekülün çevresel olarak üç boyutlu yapısı oluşturulur. Hassas bir üç boyutlu yapı elde etmek için genellikle birkaç bin kadar iki boyutlu resim kullanılır. Simetrik olmayan yapılar için bu oluşturulan üç boyutlu desenlerin hassasiyeti 1 ila 2 nanometre civarındadır. Hatta daha iyi belirlenmiş yapılar için hassasiyet nanometre altına düşer.
Virüslerin protein kılıfları gibi simetrik oligomerlerde elde edilen üç boyutlu resmin hassasiyetini artırmak için simetri bilgisi de kullanılarak modelleme yapılır.
Saçınım teknikleri
Küçük açılı saçınım teknikleri çözelti içinde bulunan nesnelerin boyutları ve biçimleri hakkında bilgi toplamaya olanak sağlar. Biyolojik saçınım yöntemlerinde makromoleküllerin oligomerizasyon durumu ve biçimleri üzerine düşük çözünürlüklü veri elde edilebilir.[7]. Yapısal biyolojide iki farklı küçük açılı saçınım yöntemi kullanılır: X ışınları saçınımı (SAXS: small angle X-ray scattering) ve nötron saçınımı (SANS : small angle neutron scattering')
Bu deneysel yöntemlerin prensipleri aslında basittir. Üzerinde çalışılacak makromolekülün konsantre çözeltisi paralel X ışınları ya da nötron akışı içine yerleştirilir. Çözelti içindeki nesneler üzerlerine düşen dalgaları saçılıma uğratır. X ışınlarında saçılma elektron bulutu ile fotonlar arasındaki etkileşimdem kaynaklanırken nötronlarda ise çözeltideki molekülün atom çekirdekleri ile oluşan etkileşimden kaynaklanır. Saçınıma uğrayan sinyalin şiddeti farklı açılara göre tespit edilir. Üzerinde çalışılan molekülün tüm oryantasyonları için bir ortalama değer olan sinyal sonucunda molekülün boyutu ve dış kabuk biçim hakkında bilgi edinilir. Özellikle virüsler gibi içsel simetri sahibi moleküller için 1 nanometrelik çözünürlüğe kadar hassas modeller elde edilebilir.
Moleküler modelleme
Moleküler modelleme yapısal biyoloji ile biyoenformatik dallarının kesişiminde olan bir yöntemlerbütünüdür. Moleküler yapıları oluşturmak, yapısal tahminlerde bulunmak[8] ya da makromoleküllerin dinamik özelliklerini analiz etmek için bilişsel yöntemlerle yapılan hesaplama yöntemlerini içerir. Minimal enerji için atomların hareket etmesini sağlayan moleküler kuvvetlerin tanımlamasına dayanır.
Veri tabanı
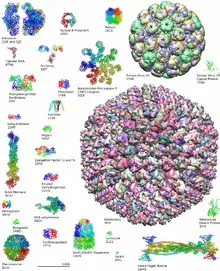
Biyolojik makromolekül yapıları üzerine gerekli bilgiler kamuya açık Protein Veri Bankası (PDB: Protein Data Bank) adlı veri tabanında saklanır.[9]. PDB'de 2014 Mayıs ayı itibarıyla 100.000'den fazla makromolekülün atom koordinatlarının bulunduğu yapısal veriler standart bir format hâlinde saklanmaktadır. Bu bilgiler çevrimiçi olarak serbestçe ulaşılabilir ve çeşitli interaktif yazılımlar kullanılarak üç boyutlu yapılar izlenebilir.
PDB'de yer alan biyolojik yapılar 4 alfanümerik karakterden oluşan bir kod ile tanımlanırlar. Genellikle ilk karakter bir rakamdır. Örneğin ispermeçet balinasının miyozin molekülünün kodu 1MBO30 Haziran 2020 tarihinde Wayback Machine sitesinde arşivlendi.'dur[10]). Akademik dergilerin çoğunda yayın yapabilmenin ön koşulu PDB'ye yapıların girilmesi olduğu için, PDB içinde bilimsel literatürde yayımlanmış moleküler yapıların çoğunluğu bulunmaktadır.
Günümüzde PDB'de bulunan ve X ışınları kristalografisi yöntemi ile belirlenmiş biyolojik makromoleküllerin yapısı çoğunlukla sinkrotron radyasyonu yöntemiyle elde edilmiştir. Biyolojik makromoleküllerin üç boyutlu yapısını belirlemede sinkrotron kullanımı, PDB'ye 1995 yılından beri yapılan kayıtların %80'ini belirlemek için kullanılmıştır.[11]
Yapısal biyoloji uygulamaları
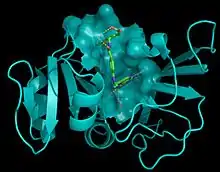
Katalik mekanizmaların anlaşılması açısından biyokimya ve enzimoloji alanlarında yapısal biyoloji önemli uygulamalara sahiptir. En önemli uygulama alanlarından biri ilaç tasarımıdır. Özellikle hedef alınan biyolojik yapıların üç boyutlu yapıları kullanılarak ligandların tasarlanmasında büyük yarar sağlamaktadır.
Kaynakça
- Kendrew, J.C.; Bodo, G.; Dintzis, H.M.; Parrish, R.G.; Wyckoff, H.; Phillipps, D.C. (1958). "A three-dimensional model of the myoglobin molecule obtained by x-ray analysis". Nature. Cilt 181. ss. 662-666. PMID 13517261.
- Banaszak, Leonard J. (2000). Foundations of Structural Biology. Burlington: Elsevier. ISBN 9780080521848.
- Karplus, Martin; McCammon, J. Andrew (1 Eylül 2002). "Molecular dynamics simulations of biomolecules". Nature Structural Biology. 9 (9). ss. 646-652. doi:10.1038/nsb0902-646. PMID 12198485.
- "Direct Electron Detectors". Methods in Enzymology. Cilt 579. 2016. doi:10.1016/bs.mie.2016.05.056. ISSN 0076-6879. 8 Haziran 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Haziran 2020.
- Nogales, Eva (2016). "The development of cryo-EM into a mainstream structural biology technique". Nature methods. 13 (1). ss. 24-27. ISSN 1548-7091. PMC 4913480 $2. PMID 27110629.
- Dardel, Frédéric; Maillavin, Thérèse (2002). "Structure des protéines par RMN". Éditions techniques de l'ingénieur. Cilt TI053. ss. AF6608. 24 Temmuz 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Haziran 2020.
- Svergun, D.I.; Koch, M.H.J. (2003). "Small-angle scattering studies of biological macromolecules in solution". Rep. Prog. Phys. Cilt 66. ss. 1735-82. Bibcode:2003RPPh...66.1735S. doi:10.1088/0034-4885/66/10/R05.
- Simonson, Thomas (2005). "Le « problème du repliement » Peut-on prédire la structure des protéines ?" (PDF). Médecine/Sciences. Cilt 21. s. 609-612. PMID 15985203. 3 Mart 2016 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 9 Haziran 2020.
- Berman, H.M.; Westbrook, J.; Feng, Z.; Gilliland, G.; Bhat, T.N.; Weissig, H.; Shindyalov, I.N.; Bourne, P.E. (2000). "The Protein Data Bank". Nucleic Acids Res. doi:10.1093/nar/28.1.235. PMID 10592235.
- Phillips, S. E. (5 Ekim 1980). "Structure and refinement of oxymyoglobin at 1.6 A resolution". Journal of Molecular Biology. 142 (4). ss. 531-554. ISSN 0022-2836. PMID 7463482. 13 Şubat 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Haziran 2020.
- "Statistics by Year : BioSync". biosync.sbkb.org. 9 Haziran 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Haziran 2020.
- Matthews, D.A.; Alden, R.A.; Bolin, J.T.; Freer, S.T.; Hamlin, R.; Xuong, N.; Kraut, J.; Poe, M.; Williams, M.; Hoogsteen, K. (1977). "Dihydrofolate reductase: x-ray structure of the binary complex with methotrexate". Science. Cilt 197. ss. 452-455. doi:10.1126/science.17920. PMID 17920.
Konuyla ilgili yayınlar
- J. Janin & M. Delepierre (1997) Biologie structurale : Principes et méthodes biophysiques, Hermann, Paris, 978-2705662325 (Fransızca)
- C. Branden & J. Tooze (1998) Introduction to Protein Structure, Garland Science, 978-0815323051 (İngilizce)
Dış bağlantılar
- Nature: Structural & Molecular Biology dergisi internet sitesi18 Nisan 2012 tarihinde WebCite sitesinde arşivlendi
- Journal of Structural Biology3 Mayıs 2020 tarihinde Wayback Machine sitesinde arşivlendi.
- Structural Biology - The Virtual Library of Biochemistry, Molecular Biology and Cell Biology (Yapısal Biyoloji - Biyokimya, Moleküler Biyoloji ve Hücre Biyolojisi Sanal Kütüphanesi)18 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi.
- Avrupa'da Yapısal Biyoloji22 Eylül 2020 tarihinde Wayback Machine sitesinde arşivlendi.
- Avrupa Protein Veri Bankası, yapısal biyoloji uluslararası veritabanı18 Eylül 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Japonya Protein Veri Bankası, yapısal biyoloji uluslararası veritabanı18 Eylül 2020 tarihinde Wayback Machine sitesinde arşivlendi.
- ABD'de yapısal biyoenformatik araştırma portali28 Ağustos 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Proteopedia, Protein Veri Bankası moleküler yapılarının interaktif görüntülenmesini sağlayan viki7 Ocak 2009 tarihinde Wayback Machine sitesinde arşivlendi.

