Alken
Alkenler (diğer bir deyişle olefinler ya da "yağ oluşturucular") yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan Alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluştururlar. Bu homolog serilerin genel formülü CnH2n şeklindedir. Bur da n- in en az 2 olma şartı vardır. Aşağıda en basit alken olan Eten'in yaygın ismilye Etilenin çeşitli modellemelerle çizilmiş şekillerinin yanı sıra aleknlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.[1]
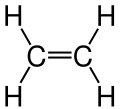 En Basit Alken olan Etenin Yapı Modeli
En Basit Alken olan Etenin Yapı Modeli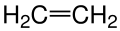 Etenin Yapı Modelinin Değişik Bir Yazım Şekli
Etenin Yapı Modelinin Değişik Bir Yazım Şekli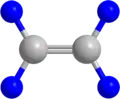 Etenin Top-Çubuk Modeli.Burada maviyle gösterilenler Hidrojen atomu gri olanlar ise Karbon atomlarıdır.
Etenin Top-Çubuk Modeli.Burada maviyle gösterilenler Hidrojen atomu gri olanlar ise Karbon atomlarıdır. Etenin Uzay-Dolgu Modeli.Mavi olanlar Hidrojen atomu gri olanlar ise Karbon atomlarıdır.
Etenin Uzay-Dolgu Modeli.Mavi olanlar Hidrojen atomu gri olanlar ise Karbon atomlarıdır.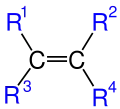 Burada R ile gösterilen kısımlar organik kısımlardır
Burada R ile gösterilen kısımlar organik kısımlardır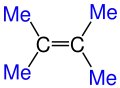 Burada Me ile gösterilen kısımlar Metil (CH3) grubunun Kısaltılmış halidir.
Burada Me ile gösterilen kısımlar Metil (CH3) grubunun Kısaltılmış halidir.
Yapıları
Şekilleri
VSEPR teorisiyle varsayıldığı üzere alkenlerde çift bağ yapan karbon atomlarının arasında yaklaşık 120° açı oluşmaktadır. Bu açı Van der Waals etkileşimleri ve bağa katılmayan fonksiyonel grupların etkileri ile değişebilir. Örnek olarak propen molekülünde bağ açısı 123.9° dir. Alken çift bağı tekli kovalent bağdan daha güçlüdür ve 133 pikometre daha kısadır.
Moleküler geometri
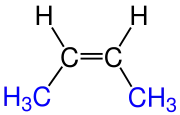 |
| cis-2-büten |
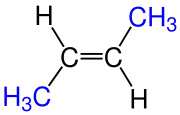 |
| trans-2-büten |
Tekli kovalent bağlarda olduğu gibi çift bağlar da üst üste gelen atomik orbitaller olarak tanımlanabilir. Ancak tekli kovalent bağ sadece bir adet sigma bağından oluşurken, çift kovalent bağ bir sigma bir pi bağından meydana gelmiştir.
Çift bağa dahil olan her karbon kendi üç sp2 hibrit orbitalini, üç atomla sigma bağı yapmak için kullanır. Hibritleşmemiş ve diğer üçünün oluşturduğu düzleme göre dik açıda kalan ‘’2p’’ orbitalleri etkileşerek pi bağını oluştururlar.
Pi bağını kırmak için büyük miktarlarda enerji gerektiğinden (etilende 264 joule/mol) karbon-karbon çift bağını döndürmek oldukça zordur ve büyük oranda kısıtlanmıştır. Bunun sonucu olarak sübsitüyent bağlı alkenlerde ‘’cis’’ ve ‘’trans’’ olmak üzere iki geometri izomeri türü oluşabilir. Örnek olarak ‘’cis’’-2-büten molekülünde metil sübsitüyentler aynı tarafa bakarken ‘’trans’’-2-büten molekülünde metil sübsitüyentler ters tarafa bakarlar.
Biri çift bağı çevirmek zor olsa da imkânsız değildir. Gerçekte, 90°lik bir çevirme işlemi pi bağının gücünün yarısına eşittir. P orbitallerinin yanlış yerleşimi beklenenden azdır çünkü piramidal yapı oluşmaya başlar. (Bkz: Piramidal alken)
Alkenlerin Özellikleri
Alkenler etenden bütene kadar olanlar gaz , 5 karbonlu pentenden 15 karbonlu Pentadekene kadar olanlar sıvı ve yapısında 15’den fazla karbon bulunduran alkenler ise normal şartlar altında katı haldedirler. Alkenler suda zor çözülen organik bileşiklerdir. Karbon- karbon arasındaki tekli bağlar karbon-karbon çift bağlara göre daha kuvvetlidirler. Bu yüzden alkenlerde yapılarındaki çift bağları bozma eğilimi vardır. Bundan dolayı alkenler reaktifdirler. Alkenler halojenlerle halojenalkanlere dönüşürler. Alkenler petrokimya endüstrisinde katkı malzemesi olarak kullanılmaktadır çünkü birçok reaksiyona katılabilme özelliğine sahiptirler.
Alkenlerde Adlandırma
| Alkenlerin Adlandırılmasında Dikkat Edilecek Hususlar | ||
| 1 |
 fremeless |
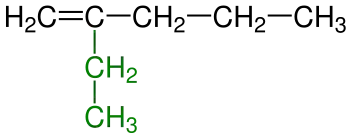 |
| 1a) | 1b) | |
| 2 | 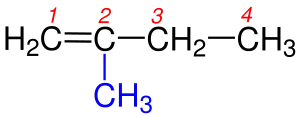 fremeless |
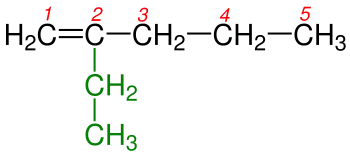 |
| 2a) Renkli kısım Sübtitüent grubudur. | 2b) Renkli kısım Sübtitüent grubudur. | |
| 3 | 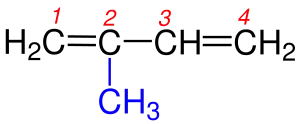 2-Metilheksan |
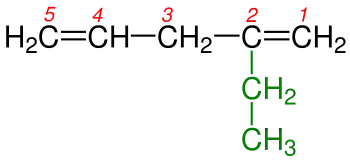 3-Metilheptan |
| 3a) 2-Metil-1,3-bütdien | 3b) 2-Etil-1,4-pentdien | |
| 4 |  3-Etil-4-metilheksan |
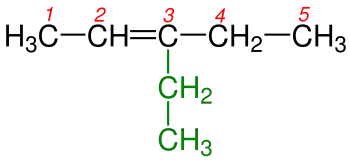 4-Etil-3-metilheksan |
| 4a) 2-Metil-1-büten | 4b) 3-Etil-2-penten | |
| 5 | 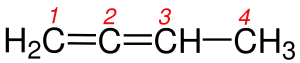 3-Etil-3-metilheksan |
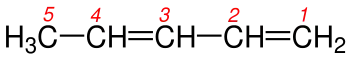 3-Etil-3-metilheptan |
| 5a) 1,2-Bütdien | 5b) 1,3-Pentdien | |
Alkenlerin IUPAC sistemine göre adlandırılması Alkanlarkine çok benzemektedir. Burada alkanlarda sona gelen -an takısı yerine alkenlerde sona -en takısı gelmektedir ve birden fazla çift bağın olması durumunda -en yerine duruma göre -dien,trien, tetraen vb. ekler gelmektedir.[2][3]
1 - İçinde karbon-karbon çift bağının bulunduğu en uzun zincir seçilir.Yandaki tabloda da gördüğümüz gibi 1b de bulunan Hidrokarbon zinciri biri 5 diğeri 6 karbon olmak üzere iki farklı zincirden oluşmaktadır. Burada bir karbon-karbon çift bağı olmasaydı adlandırma yapılırken 6 karbonlu olan zincir seçilecekti. Yalnız burada Hidrokarbon zincirinde karbon-karbon çift bağı olduğundan yapısında çift bağı içeren en uzun zincir seçilir. Bundan dolayı 5 karbonlu olan zincir seçilir.
2 - Burada numaralandırma yapılırken karbon-karbon çift bağını yapmış karbon atomlarına en küçük rakamların gelmesine dikkat edilir.
3 - Eğer çift bağ yapmış karbonlar her iki ucada eşit uzaklıktaysa numaralandırma yapılırken dallanmaya en yakın uçtan başlanılır. Şekil 3a ve 3b 'de de görüldüğü gibi karbon-karbon çift bağları her iki ucada eşit uzaklıktadılar. Burada dikkat edilecek husus numaralandırmaya sağdan ya da soldan başlamak değil dallanmaya en yakın uctan başlanmasıdır.Burada dikkat edilecek diğer bir hususda Hidrokarbon zincirlerinde ikişer karbon-karbon çift bağının bulunmasıdır. Böyle durumlarda isim -en eki yerine duruıma göre -dien , -trien , -tetraen vb. ekleri alır. Tabii ki burada tüm çift bağların yerlerinin belirtilmesi gereklidir.
4 - Çift bağı gösteren numara adlandırmada yazılırken bunlardan küçük olanı alınır.Şekil 4a 'da karbon-karbon çift bağı 1. ve 2. karbonlar arasında burada adlandırma yapılırken çift bağı belirten rakam seçilirken küçük olanı yani 1 alınır. Şekil 4b 'de karbon-karbon çift bağı 2. ve 3. karbonlar arasında burada adlandırma yapılırken küçük rakam olan 2 alınır.
5 - Eğer molekülde birden fazla çift bağ varsa, numaralandırma yapılırken çift bağın uca en yakın olan kısmından başlanılır. Şekil 5a ve 5b 'de de olduğu gibi her iki molekülde de çift bağ vardır ama dallanma yoktur bu yüzden burada numaralandırma yapıldığında karbon-karbon çift bağın en yakın olduğu uctan başlanılır.
Katılma tepkimeleri
Alkenler çift bağın açıldığı birçok katılma tepkimesine girer. Alkenlerde genel olarak katılma tepkimeleri sonucunda alkanlar oluşmaktadır. Alkenlerin karbon-karbon çift bağının bulunduğu karbonlar arasında biri Sigma (σ) diğeri pi (π) bağı olmak üzere iki tane bağ vardır. Alkenlerdeki katılma tepkimelerinde işte bu karbonlar arasındaki pi (π) bağı kırılır ve yerine tepkimeye katılan element veya elementlerle iki tane sigma (σ) bağı oluşturulur.[4]

- Hidrojenin katalitik katılması: Bu katılma tepkimesinde söz konusu alken alkan türüne çevirir. Tepkime metal bir katalizör varlığında yapılır. Yaygın katalizörlerde kullanılan metaller platinyum, nikel ve paladyumdur. Labratuvar sentezinde Raney nikeli kullanılır. Bu katalizör bir nikel-alüminyum alaşımıdır. Bu tepkime için tipik bir örnek, etilenin katallitik hidrojenleme yöntemiyle etana çevrilmesidir:
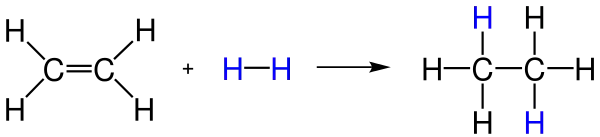
- Halojenleme: Elementar haldeki brom ve klorun alkenlere katılmasıyla sırasıyla benzer dibrom ve dikloroalkenler ortaya çıkar. Bir brom solüsyonunun suda renk değiştirmesi alken varlığının analitik testidir.Aşağıdaki örneğe baktığımızda yukardaki örnekten farklı olarak katılan elementlerinin biri aşağıya diğeride yukarıya yazılmak yerine ikisi de aşağıya yazılmıştır. Burada bunların böyle yazılmasının amacı iki karbon atomunun arasındaki tek bağların denebildiklerinden dolayı farkın olmadığını göstermketir. Yani anlayacağınız her iki elementi burada aşağıya, yukarıyada ya da birini aşağıya birini yukarıya yazmanız fark etmez.

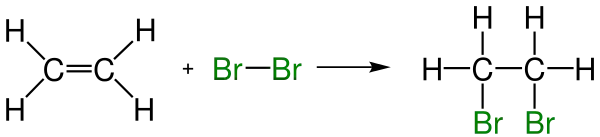
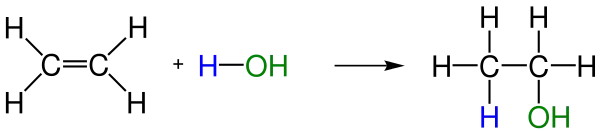
- Alkenlere Suyun Katılması : Alkenlere suyun katılmasıyla alkoller oluşmaktadır.
- Hidrohalojenleme: HCl veya HBr gibi hidrolik asitlerin alkenlere katılımıyla haloalkanler meydana gelir. Alkenlerde Hidrojen ve Halojenlerin katılmalarında iki farklı durum ortaya çıkar. Eğer katılmaya giren alken eten gibi sadece birincil karbonlardan oluşan bir alken ise tepkime aşağıdaki gibi sonuçlanır. Burada halojenin veya Hidrojenin nereye bağlanması o kadar fark etmemektedir çünkü burada sadece birincil karbon atomları vardır.
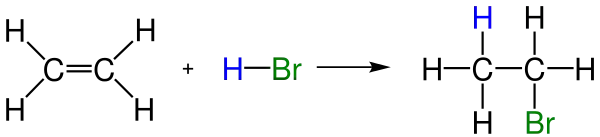
Yalnız ikinci örneğe baktığımızda burada hem birincil hem de ikincil karbon atomları vardır. Bu yüzden burada hidrojenin bağlanacağı karbon atomu önemlidir. Eğer Hidojen atomu ikinci karbona bağlanırsa 1a gösterilen ve daha kararlı olan Karbonuyum iyon oluşur. Şayet ikinci karbon yerine birinci ye bağlanırsa bu sefer 2b ile gösterilen Karbonuyum iyonu oluşur. Böyle durumlarda 2a durumdaki olan ürünün oluşması daha muhtemeldir çünkü ikincil karbonuyum iyon birincil karbonuyum iyondan daha kararlıdır. İşte bu şekilde daha kararlı olan karbonuyum iyonun oluşmasına Markovnikov kuralı denir. 2b ile gösterilen ürün oluşmaz çünkü kararlı karbonuyum iyonlar önceliklidir.

Oksidasyon
Alkenler büyük sayıdaki yükseltgenler ile oksitlenebilirler.
- Oksijenin varlığında alkenler karbondioksit ve su açığa çıkaracak şekilde açık bir alevle yanarlar.
- Oksijenle katalitik oksidasyon veya perkarboksilik asitlerle reaksiyonda epoksitler oluşur.
- ozonoliz'de ozonla gerçekleştirilen reaksiyon çift bağların kırılmasına yol açar ve açığa iki aldehid veya keton çıkar.
- R1-CH=CH-R2 + O3 → R1-CHO + R2-CHO + H2O
- Bu reaksiyon bilinmeyen bir alkenin çift bağlarının pozisyonlarını belirlemede kullanılabilir.
Polimerizasyon
Alkenlerin polimerizasyonu polietilen ve polipropilen plastikleri gibi yüksek endüstri değerli polimerleri açığa çıkaran ekonomik olarak önemli bir reaksiyondur. Polimerizasyon hem köksüz hem de iyonik olarak devam edebilen bir mekanizmadır.
Sentez
- Alkenler için en yaygın endüstriyel sentezleme işlemi petrolün krakingleştirilmesidir.
- Alkenler su katılarak alkolün dehidrasyonundan sentezlenebilirler. Örneğin, etanolün dehidrasyonu eten ortaya çıkarır:
- CH3CH2OH + H2SO4 (conc. aq) → CH3CH2OSO3H + H2O → H2C=CH2 + H2SO4 + H2O
- Diğer alkol eliminasyonları Chugaev eliminasyonu ve ilk olarak alkol grubunun kısa ömürlü bir ara ürüne dönüştüğü Grieco eliminasyonudur.
- Hofmann tepkimesi ve Cope tepkimesinda alken üretmek için alkil aminden bir ayrılma tepkimesi meydana gelir. β-haloeterlerle Boord olefin sentezi ve ester erimesinde daha fazla ayrılma tepkimesi meydana gelir.
- Yüksek α-alkenlerinin katalitik sentezleri nikel, kobalt veya platinyum varlığında organometalik bileşik olan trietilaluminyumla etilenin reaksiyonu sonucu gerçekleşebilir.
- Alkenler olefin metatezinde karıştırılır..
- Alkenler çeşitli reaksiyonlar sonucunda aldehid veya keton gibi karbonil grubu bileşiklerinden üretilebilirler.
- Wittig reaksiyonunda alkil halid ile reaksiyon
- Julia olefinasyonunda fenil sülfan ile reaksiyon
- Barton-Kellogg reaksiyonunda iki farklı ketonun reaksiyonu
- Bamford-Stevens reasiyonu veya Shapiro reaksiyonunda bir ketonun etkileşimi
- McMurry reaksiyonunda iki keton veya iki aldehidin etkileşimi
- Alkenler vinil halojen tuzunun etkileşim reaksiyonundan üretilebilirler.
- Alkenler alkinlerin seçici indirgenmelerinden üretilebilir.
- Alkenler Diels-Alder reaksiyonu ve Ene reaksiyonunda yeniden düzenlenirler.
- Alkenler Ramberg-Bäcklund Reaksiyonunda α-halo sulfonlarından üretilebilirler.
- Çokça yeni etkileşimler geçiren alkenlar çeşitli organometalik ayraçlarla karbometalasyonda alkinden oluşturulabilirler.
Simetrik olmayan ürünlerde yerine koyma reaksiyonu geçiren karbonlar (az hidrojenli) çift bağlarda daha sabit bir bölgeye yerleşme eğilimindedirler. (Bkz. Saytzeff kuralı).
E,Z Yazımı
Bir alkenin birden fazla yedek atomu bulunduğu zaman çift bağın geometrisi E ve Z etiketleri kullanılarak gösterilir. Bu etiketler, "karşıt" manasındaki "entgegen" ve "birlikte" manasındaki "zusammen" Almanca kelimelerinden gelmektedir. Çift bağlı atomların aynı taraftaki yüksek öncelikli grupları birlikte diye tanımlanır ve Z ile gösterilir. Karşı taraftaki yüksek öncelikli gruplar ise E ile gösterilmektedir.
Kaynakça
- Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 85.
- T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 144-145
- Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 87-88
- T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 321-326
