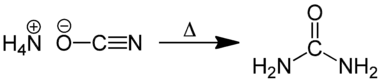Üre
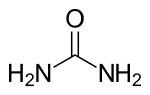
Üre (Latince Urea Pura), organik bir bileşik. Formülü H2N-CO-NH2'dir. Karbonik asidin diamidi olan üre aynı zamanda karbamik asidin de amidi olduğundan karbamid adı ile de bilinir.
| Üre | |
|---|---|
 | |
 Üre molekülünün top ve çubuk modeli |
 Üre molekülünün boşluk doldurma modeli |
 | |
Amino metanamid | |
Diğer adlar Karbamid, karbonil diamid, karbonildiamin, diaminometanal, diaminometanon | |
| Tanımlayıcılar | |
| CAS numarası | 57-13-6 |
| PubChem | 1176 |
| DrugBank | DB03904 |
| KEGG | D00023 |
| ChEBI | 16199 |
| RTECS numarası | YR6250000 |
| ATC kodu | B05,Şablon:ATC |
| SMILES |
|
| InChI |
|
| ChemSpider | 1143 |
| Özellikler | |
| Kimyasal formül | CH4N2O |
| Molekül kütlesi | 60,06 g mol−1 |
| Görünüm | Beyaz katı |
| Yoğunluk | 1.32 gr/cm3 |
| Erime noktası |
133 – 135 °C |
| Çözünürlük (su içinde) | 107.9 gr/100 ml (20 °C) 167 gr/100ml (40 °C) 251 gr/100 ml (60 °C) 400 gr/100 ml (80 °C) |
| Çözünürlük () | 500 gr/L gliserin,[1] 50 gr/L etanol |
| Baziklik (pKb) | pKBH+ = 0.18[2] |
| Tehlikeler | |
| GHS piktogramları |  |
| NFPA 704 |
 1
1
0
|
| Parlama noktası | Yanıcı değildir |
| LD50 | 8500 mg/kg (oral, sıçan) |
| Benzeyen bileşikler | |
Benzeyen üreler |
Tiyoüre Hidroksikarbamid |
Benzeyen bileşikler |
Karbamid peroksit Üre fosfat Aseton Karbonik asit Karbonil florür |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Ürenin ilk defa 1773 yılında keşfedildiği bilinir. Ancak şüpheden uzak kesin sentezi 1828'de Wöhler tarafından başarılmıştır. Keşfinden bu yana 50'den fazla tepkimede üre bir ürün olarak elde edilmiştir.
Amonyum karbonatın 150-200 °C'ye kadar ısıtılmasından üre elde edilir ki bu teknik bir metoddur. Wöhler sentezi olarak bilinen reaksiyonda ise; önce KCN ile PbO2 karışımı ısıtılarak KCNO elde edilir. KCNO nun amonyum sülfat ile muamelesi sonucu hazırlanan amonyum siyanatın kızdırılmasıyla da üre elde edilir. Üre 132 °C'de eriyen rombik prizmalar veya iğne şeklinde renksiz kristaller verir. Su ve alkolde iyi çözünür. Kloroform, eter veya etil asetatta çözünmez. 132 °C'nin üstünde amonyak, siyanür asidi gibi ürünler vererek bozunur. Nitrik asit, sodyum hipoklorit veya sodyum hipobromit gibi bileşiklerin etkisiyle azot, su ve karbondiokside ayrışır. Seyreltik asit veya alkalilerle ısıtıldığında amonyak ve karbondioksite bozunur.
En çok gübre ve hayvan yemi olarak kullanılan üreden ilaç ve plastik yapımında da faydalanılır. Üre asit ve tuzlarla bir takım katılma bileşikleri, bazı asitlerle de kondensasyon ürünleri veya üreidleri verir. Naftalinin türevleriyle verdiği bileşikleri terapide kullanılır. Boya üretiminde de kullanılan üre aynı zamanda bitkiler için bir besin kaynağıdır. Nitrik asitle gübre ve patlayıcı madde olarak kullanılan üre nitrat adı verilen bir tuz oluşturur.
Fizyolojik önemi
Üre, fizyolojik önemi bulunan bir bileşiktir. Memelilerin vücudunda protein maddelerinin yakılması sonucu meydana gelen amonyak, karaciğerde karbondioksitle üreye dönüşür. Kana geçen üre, idrarla dışarıya atılır. Üre ayrıca az miktarda ter, süt ve gözyaşında da bulunur. Yetişkin bir insan günde 25-30 gram üreyi idrarla atar. İnsan kanındaki üre miktarı normalde % 50 mg civarındadır. % 50 mg'ın üstü anormaldir. Fakat vücut yaşlandıkça, böbreklerin üreyi vücuttan atma kabiliyeti de her geçen yıl bir parça daha azalacaktır. 40 yaşından itibaren, her yıl böbreklerin süzme kabiliyeti % 1 oranında azalmaktadır. Bu yüzden 75-80 yaşındaki bir kişide kandaki üre miktarının % 65–75 mg bulunmasını normal olarak kabul etmek gerekir. Kandaki üre miktarının beklenen normal değerin üzerinde olması haline üremi adı verilir.
Ayrıca bakınız
- Wöhler üre sentezi
Notlar
Kaynakça
- "Solubility of Various Compounds in Glycerine" (PDF). 13 Nisan 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 26 Mart 2020.
- Williams, R. (24 Ekim 2001). "pKa Data" (PDF). 18 Şubat 2015 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 27 Kasım 2009.
- J. Shorter (1978). "The conversion of ammonium cyanate into urea—a saga in reaction mechanisms". Chemical Society Reviews. 7 (1). Royal Society of Chemistry. ss. 1-14. doi:10.1039/CS9780700001. 4 Mart 2016 tarihinde kaynağından arşivlendi.
- Wöhler'in "Amonyum siyanat üredir" açıklaması yanlıştır. Bunlar iki farklı kimyasal madde olup standart koşullar altında ağırlıklı olarak üre lehine olan bir kimyasal denge içerisindedirler.[3]