Tropinon
Tropinon, bir alkaloiddir. Atropinin sentetik habercisi olarak 1917 yılında, Robert Robinson tarafından sentezlenmesiyle I. Dünya Savaşı sırasında az bulunan bir malzeme olarak ün kazanmıştır.[1][2] Tropinon, kendisi gibi birer alkaloid olan kokain ve atropin ile aynı tropan çekirdek yapısını paylaşır. pH 7,3 'te karşılık gelen konjuge asidi, tropiniumon olarak bilinir.[3]
| Tropinon | |
|---|---|
 | |
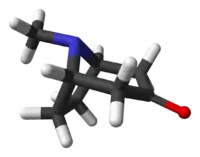 | |
8-Methyl-8-azabicyclo[3.2.1]octan-3-one | |
Diğer adlar 3-Tropinon | |
| Tanımlayıcılar | |
| CAS numarası | 532-24-1 |
| PubChem | 446337 |
| DrugBank | DB01874 |
| ChEBI | 16656 |
| SMILES |
|
| InChI |
|
| ChemSpider | 393722 |
| Özellikler | |
| Molekül formülü | C8H13NO |
| Molekül kütlesi | 139.195 g/mol |
| Görünüm | Kahverengi katı |
| Erime noktası |
42.5°C |
| Kaynama noktası |
(ayrışır) |
| Tehlikeler | |
| NFPA 704 |
 1
2
0
|
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Sentez
Tropinonun ilk sentezi 1901'de Richard Willstätter tarafından yapılmıştır. Senteze, görünüşte bileşik ile ilişkili olan sikloheptanondan başlandı, ancak nitrojen köprüsünü kurmak için birçok adım gerekti. Sentez yolu için toplam verim sadece % 0,75'tir.[4] Willstätter daha önce tropinondan kokain sentezlemiştir ki bu, kokain yapısının ilk sentezi ve açıklanmasıdır.[5]
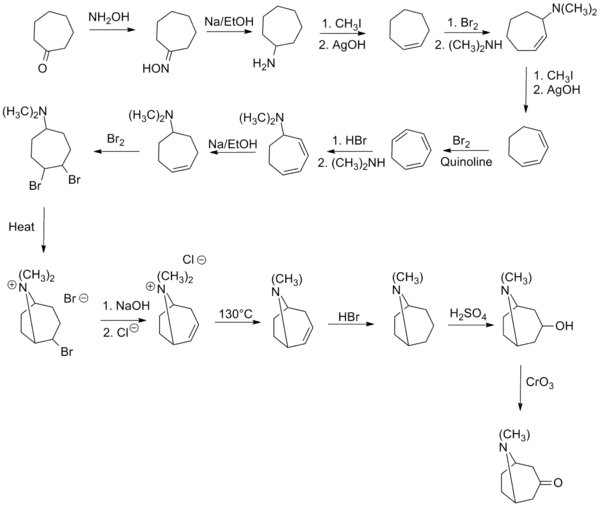
Robinson'un "çifte Mannich" reaksiyonu
Robinson'un 1917 sentezi, basitliği ve biyomimetik yaklaşımı nedeniyle toplam sentezde bir klasik olarak kabul edilir.[7] Tropinon bisiklik bir moleküldür ancak hazırlanmasında kullanılan reaktantlar oldukça basittir. Bunlar süksinaldehit, metilamin ve asetonikarboksilik asit (veya hatta aseton) şeklindedir. Sentez, biyomimetik reaksiyonun veya biyogenetik tip sentezin iyi bir örneğidir çünkü biyosentez aynı yapı taşlarını kullanır. Aynı zamanda "one-pot" bir sentezde tandem bir reaksiyon gösterir. Ayrıca, sentez verimi % 17 idi ve sonraki gelişmelerle % 90'ı aştı.[8]
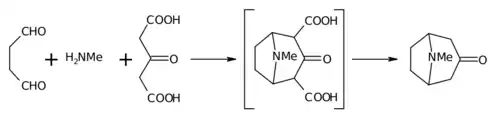
Bu reaksiyon, bariz nedenlerden dolayı molekül içi bir "çift Mannich reaksiyonu" olarak tarif edilir. Daha önce de piperidin sentezinde denendiği için bu açıdan benzersiz değildir.[9][10]
Aseton yerine asetonikarboksilik asit, "sentetik eşdeğer" olarak bilinir ve 1,3-dikarboksilik asit grupları, halka oluşturma reaksiyonlarını kolaylaştırmak için "aktive edici gruplar" olarak adlandırılır. Kalsiyum tuzu, reaksiyonun "fizyolojik pH" da gerçekleştirilmesi durumunda daha yüksek verimlerin mümkün olduğu iddia edildiği için bir "tampon" olarak mevcuttur.
Reaksiyon mekanizması
Reaksiyon dizisinde görülen ana özellikler şunlardır:
- Metilaminin, süksinaldehide nükleofilik katılımı, ardından bir imin oluşturmak için su kaybı
- İkinci aldehit birimine iminin molekül içi eklenmesi ve ilk halka kapanması
- Aseton dikarboksilat enolatının moleküller arası Mannich reaksiyonu
- Yeni enolat oluşumu ve su kaybı ile yeni imin oluşumu
- İkinci molekül içi Mannich reaksiyonu ve ikinci halka kapanması
- 2 karboksilik grubun tropinona kaybı
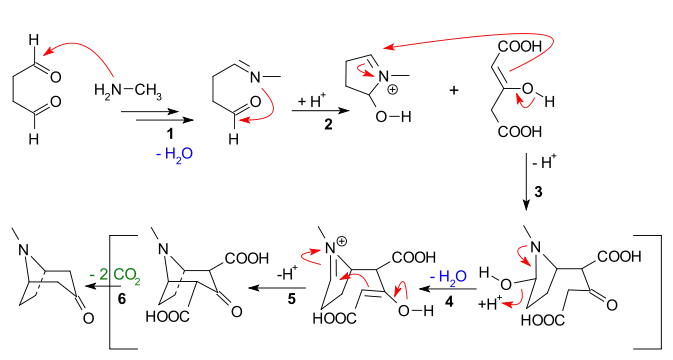
Bazı otoriteler aslında CO2H gruplarından birini tutmaya çalıştılar.[11]
CO2R-tropinon, 4 stereoizomere sahiptir, ancak karşılık gelen ekgonidin alkil ester sadece bir çift enantiyomere sahiptir.
Tropinonun redüksiyonu
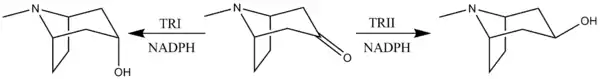
Tropinonun redüksiyonuna, birçok bitki türünde karakterize olan NADPH'ye bağlı redüktaz enzimleri aracılık eder. [12] Bu bitki türlerinin tümü, iki tür redüktaz enzimi (tropinon redüktaz I ve tropinon redüktaz II) içerir. TRI tropin üretir ve TRII psödotropin üretir. Enzimlerin farklı kinetik ve pH / aktivite özellikleri nedeniyle ve TRI'nin TRII'ye göre 25 kat daha yüksek aktivitesi nedeniyle, tropinon indirgemesinin çoğu TRI'den tropin oluşumuyla gerçekleşir. [13]
Kaynakça
- Robinson (1917). "LXIII. A Synthesis of Tropinone". Journal of the Chemical Society, Transactions. 111: 762-768. doi:10.1039/CT9171100762.
- Nicolaou (2000). "The Art and Science of Total Synthesis at the Dawn of the Twenty-First Century". Angewandte Chemie International Edition. 39 (1): 44-122. doi:10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L. PMID 10649349.
- "tropiniumone (CHEBI:57851)". www.ebi.ac.uk. Erişim tarihi: 3 Kasım 2020.
- Organic Synthesis. 1998. doi:10.1039/9781847551573. ISBN 978-0-85404-544-0.
- Humphrey (2001). "Tropane alkaloid biosynthesis. A century old problem unresolved". Natural Product Reports. Royal Society of Chemistry. 18 (5): 494-502. doi:10.1039/b001713m. PMID 11699882.
- Green Chemistry and Engineering. Oxford: Elsevier. 2007. s. 34. ISBN 978-0-12-372532-5.
- Birch, A. J. (1993). "Investigating a Scientific Legend: The Tropinone Synthesis of Sir Robert Robinson, F.R.S". Notes and Records of the Royal Society of London. 47 (2): 277-296. doi:10.1098/rsnr.1993.0034. JSTOR 531792.
- Smit, Wim A.; Smit, William A.; Bochkov, Alekseĭ Feodosʹevich; Caple, Ron (1998). Organic Synthesis. doi:10.1039/9781847551573. ISBN 978-0-85404-544-0.
- Wang, S.; Sakamuri, S.; Enyedy, I. J.; Kozikowski, A. P.; Deschaux, O.; Bandyopadhyay, B. C.; Tella, S. R.; Zaman, W. A.; Johnson, K. M. (2000). "Discovery of a novel dopamine transporter inhibitor, 4-hydroxy-1-methyl-4-(4-methylphenyl)-3-piperidyl 4-methylphenyl ketone, as a potential cocaine antagonist through 3D-database pharmacophore searching. Molecular modeling, structure-activity relationships, and behavioral pharmacological studies". Journal of Medicinal Chemistry. 43 (3): 351-360. doi:10.1021/jm990516x. PMID 10669562.
- Wang, S.; Sakamuri; Enyedy; Kozikowski; Zaman; Johnson (2001). "Molecular modeling, structure--activity relationships and functional antagonism studies of 4-hydroxy-1-methyl-4-(4-methylphenyl)-3-piperidyl 4-methylphenyl ketones as a novel class of dopamine transporter inhibitors". Bioorganic & Medicinal Chemistry. 9 (7): 1753-1764. doi:10.1016/S0968-0896(01)00090-6. PMID 11425577.
- Findlay, S. P. (1957). "Concerning 2-Carbomethoxytropinone". Journal of Organic Chemistry. 22 (11): 1385-1394. doi:10.1021/jo01362a022.
- A. Portsteffen (1992). "Two tropinone reducing enzymes from Datura stramonium transformed root cultures". Phytochemistry. 31 (4): 1135. doi:10.1016/0031-9422(92)80247-C.
- "Specificities of the enzymes of N-alkyltropane biosynthesis in Brugmansia and Datura". Phytochemistry. 52 (5): 871-8. Kasım 1999. doi:10.1016/S0031-9422(99)00293-9. PMID 10626376.
