Gümüş nitrat
Gümüş nitrat en önemli gümüş tuzudur. Renksiz ağır kristaller teşkil eder. Tıpta dağlamak maksadıyla kullanılır ve antibakteriyel özelliği vardır. Bu özelliğinden dolayı siğil tedavisinde sıkça kullanılır. Ayrıca deriyi ve organik maddeleri karartmada tercih edilir. Deriyi kararttığından cehennem taşı ismini almıştır. Suda ve alkolde kolayca çözündüğünden birçok gümüş bileşiklerinin elde edilmesinde ilkel madde olarak kullanılır. En çok kullanıldığı yerler, başta fotoğrafçılık olmak üzere mürekkepler, saç boyası yapımı ve gümüş kaplamacılığıdır.bileşenleri gümüş ve nitrik asittir. Sentezi ise örnekteki formüle göre yapılır:
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
| Gümüş nitrat | |
|---|---|
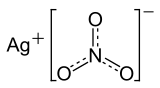 | |
 | |
Gümüş(I) nitrat, Gümüş nitrat | |
Diğer adlar Nitrik asit gümüş(1+) tuzu Cehennem taşı | |
| Tanımlayıcılar | |
| CAS numarası | 7761-88-8 |
| PubChem | 24470 |
| UN numarası | 1493 |
| ChEBI | 32130 |
| RTECS numarası | VW4725000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 22878 |
| Özellikler | |
| Kimyasal formül | AgNO3 |
| Molekül kütlesi | 169,87 g mol−1 |
| Görünüm | renksiz katı |
| Koku | Kokusuz |
| Yoğunluk | 4.35 g/cm3 (24 °C) 3.97 g/cm3 (210 °C)[1] |
| Erime noktası | |
| Kaynama noktası |
440°C ( |
| Çözünürlük (su içinde) | 122 g/100 mL (0 °C) 170 g/100 mL (10 °C) 256 g/100 mL (25 °C) 373 g/100 mL (40 °C) 912 g/100 mL (100 °C)[3] |
| Çözünürlük () | aseton,[1] amonyak, eter, gliserin’de çözünür |
| Çözünürlük (asetik asit içinde) | 0.776 g/kg (30 °C) 1.244 g/kg (40 °C) 5.503 g/kg (93 °C)[2] |
| Çözünürlük (aseton içinde) | 0.35 g/100 g (14 °C) 0.44 g/100 g (18 °C)[3] |
| Çözünürlük (benzen içinde) | 0.22 g/kg (35 °C) 0.44 g/kg (40.5 °C)[3] |
| Çözünürlük (etanol içinde) | 3.1 g/100 g (19 °C)[3] |
| Çözünürlük (etil asetat içinde) | 2.7 g/100 g (20 °C)[2] |
| log P | 0.19 |
| Termokimya | |
Standart formasyon entalpisi (ΔfH |
−124.4 kJ/mol[1] |
Gibbs serbest enerjisi (ΔfG˚) |
−33.4 kJ/mol[1] |
| Yasal durum | {{{Legal_status}}} |
| Tehlikeler | |
| GHS piktogramları |     [4] [4] |
| GHS İşaret sözcüğü | Tehlike |
| Ana tehlikeler | Etanol ile patlayıcı reaksiyona girer. Toksik. Aşındırıcı. |
| NFPA 704 |
 0
3
3
|
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Nitrat, (kim. formülü: NO3−), kimyada bir azot ve üç oksijen atomundan oluşan bir nitrik asit (kim. formülü: HNO3) tuzu iyonudur. Organik kimyada, nitrik asit ve bazı alkollerin esterlerine nitrat adı verilir. Moleküler ağırlığı 62.0049'dir. Moleküler geometrisi düzlem üçgendir ve oksijen atomları arasındaki açı 120 derecedir. Aynanın arkasına sürülüp şeker eklendiğinde ayna elde edilir. Böylece gerçek görüntü açığa çıkar. Şekerin Gümüşnitrat ile birleştirilmesi onun ayrıştırılması içindir.
Kaynakça
- Şablon:CRC90
- Kiper, Ruslan Anatolievich. "silver nitrate". Chemister.ru. 11 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Temmuz 2014.
- Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd bas.). New York: D. Van Nostrand Company. ss. 617-619.
- Şablon:Sigma-Aldrich
Dış bağlantılar
| Wikimedia Commons'ta Gümüş nitrat ile ilgili ortam dosyaları bulunmaktadır. |
- International Chemical Safety Card 1116 20 Ocak 2018 tarihinde Wayback Machine sitesinde arşivlendi.
- NIOSH Pocket Guide to Chemical Hazards 21 Şubat 2011 tarihinde Wayback Machine sitesinde arşivlendi.
