Kurşun(II) oksit
Kurşun monoksit olarak da adlandırılan kurşun(II) oksit, PbO moleküler formülüne sahip inorganik bileşiktir. PbO iki polimorfda oluşur: tetragonal kristal yapıya sahip litarj ve ortorombik kristal yapıya sahip massikot. PbO için modern uygulamalar çoğunlukla kurşun bazlı endüstriyel cam ve, bilgisayar bileşenlerini de kapsayan endüstriyel seramiklerdir. Amfoterik bir oksittir.[2]
| Kurşun(II) oksit | |
|---|---|
 | |
 | |
Kurşun(II) oksit | |
Diğer adlar Kurşun monoksit Litarj Massikot Mürdesenk Plumboz oksit | |
| Tanımlayıcılar | |
| CAS numarası | 1317-36-8 |
| PubChem | 14827 |
| UN numarası | 3288 |
| RTECS numarası | OG1750000 |
| ChemSpider | 140169 |
| Özellikler | |
| Molekül formülü | PbO |
| Molekül kütlesi | 223.20 g/mol |
| Görünüm | kırmızı veya sarı toz |
| Yoğunluk | 9.53 g/cm3 |
| Erime noktası |
888 °C |
| Kaynama noktası |
1477 °C |
| Çözünürlük (su içinde) | 0.017 g/L[1] |
| Çözünürlük () | seyreltik alkaliler, alkol’de çözünmez derişik alkalilerde çözünür HCl, amonyum klorür’de çözünür |
| Tehlikeler | |
| GHS piktogramları |    |
| GHS İşaret sözcüğü | Tehlike |
| R-ibareleri | R61, R20/22, R33, R62, R50/53 |
| G-ibareleri | S53, S45, S60, S61 |
| H-ibareleri | H302+332, H351, H360Df, H362, H372, H410 |
| P-ibareleri | P201, P260, P263, P280, P301+312+330, P308+313 |
| NFPA 704 |
 0
3
0
|
| Parlama noktası | Yanıcı değil |
| Benzeyen bileşikler | |
Diğer anyonlar |
Kurşun sülfür Kurşun selenid Kurşun tellürid |
Diğer katyonlar |
Karbon monoksit Silisyum monoksit Kalay(II) oksit |
Benzeyen |
Kurşun(II,IV) oksit Kurşun dioksit |
Benzeyen bileşikler |
Talyum(III) oksit Bizmut(III) oksit |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Yapımı
PbO, kurşun metalinin yaklaşık 600 °C’de havada ısıtılmasıyla hazırlanabilir . Bu sıcaklıkta, diğer kurşun oksitlerin havada oksidasyonunun da son ürünüdür:[3]
- PbO2 Pb12O19 Pb12O17 Pb3O4 PbO
Kurşun(II) nitrat veya kurşun(II) karbonatın termal ayrışması da PbO oluşumuna neden olur:
PbO, ham kurşun cevherlerini metalik kurşun haline getirmek için büyük bir ara ürün olarak üretilir. Kurşun cevheri çoğunlukla galen (kurşun(II) sülfür)’dir. Yaklaşık 1000 °C sıcaklıkta sülfür, oksite dönüştürülür:[4]
- 2 PbS + 3 O2 → 2 PbO + 2 SO2
Metalik kurşun, PbO’in karbon monoksit ile yaklaşık 1200 °C’de indirgenmesiyle elde edilir:[5]
- PbO + CO → Pb + CO2
Yapısı
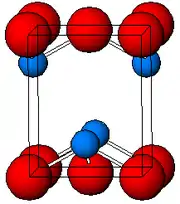
X ışını kristalografisi ile belirlendiği gibi, hem polimorflar hem de tetragonal ve ortorombik piramidal dört koordinatlı bir kurşun merkeze sahiptir. Tetragonal formda dört kurşun–oksijen bağı aynı uzunluğa sahiptir. Ancak, ortorombikte bağların ikisi daha kısa ve ikisi daha uzundur. Piramidal görünüş stereokimyasal olarak aktif yalın çift elektron varlığını gösterir.[6] PbO, tetragonal örgü yapısında meydana geldiğinde buna litarj; ve PbO, ortorombik örgü yapısına sahip olduğunda buna massikot denir. PbO kontrollü ısıtma ve soğutma ile massikottan litarja veya tersi olarak değiştirilebilir.[7] Tetragonal form genellikle kırmızı veya turuncu, ortorombik formda genellikle sarı veya turuncudur. Ancak, renk yapının çok güvenilir bir göstergesi değildir.[8] PbO’in tetragonal ve ortorombik formları doğal olarak nadir mineraller olarak bulunur.
Reaksiyonları
Bu maddenin kırmızı ve sarı formları entalpideki küçük bir değişikle ilişkilidir:
- PbO(kırmızı) → PbO(sarı) ΔH = 1.6 kJ/mol
PbO amfoteriktir, yani hem asitlerle hem de bazlarla reaksiyona girer. Asitlerle, [Pb6O(OH)6]+4 gibi okso kümelerinin aracılığıyla Pb+2 tuzları oluşturur. Kuvvetli bazlarla, PbO plumbit (plumbat(II) olarak da adlandırılır) tuzları oluşturmak için çözünür:[9]
- PbO + H2O + OH− → [Pb(OH)3]−
Uygulama alanları
Kurşun camdaki kurşun türü normalde PbO’dir. Bu nedenle, PbO cam yapımında yaygın olarak kullanılır. Cama bağlı olarak, camda PbO kullanmanın faydası camın kırılma indisini arttırmak, camın viskozitesini azaltmak, camın elektriksel özdirencini arttırmak ve camın X ışınlarını absorbe etme kabiliyetini arttırmak gibi bir veya daha fazla olabilir. PbO’in endüstriyel seramiklere eklenmesi (camda olduğu gibi), malzemeleri manyetik ve elektriksel olarak daha inert hale getirir ([[Curie sıcaklığı]nı arttırarak]) ve genelliklede bu amaçla kullanılır.[10] Tarihsel olarak PbO, ev seramikleri için seramik sırlarında da yaygın olarak kullanılmıştır ve halen kullanılmaktadır, ancak artık yaygın olarak kullanılmamaktadır. Diğer daha az baskın uygulamalar, kauçuğun vulkanizasyonu ve belirli pigmentlerin ve boyaların üretimini içerir.[2] PbO, katot ışını tüpünün camında X ışını emisyonunu engellemek için kullanılır, ancak esas olarak boyun ve hunide kullanılır çünkü ön panelde kullanıldığında renk değişikliğine neden olabilir. Ön panel için stronsiyum oksit tercih edilir.
Kurşun tüketimi ve dolayısıyla PbO'nun işlenmesi otomobil sayısı ile ilişkilidir, çünkü otomobil kurşun asit akülerinin ana bileşeni olmaya devam etmektedir.[11]
Özelleşmiş veya azalan kullanımlar
Sert, su geçirmez bir çimento oluşturacak şekilde gliserin ile PbO karışımı, akvaryumların düz cam yanlarını ve tabanlarını birleştirmek için ve ayrıca bir zamanlar pencere çerçevelerindeki cam panellerin yalıtımı için kullanılmıştır. Kurşun boyaların bir bileşenidir.
PbO, bir tür Çin konserve yumurtası olan yüzyıl yumurtalarının kalitesini yapay olarak arttırmak ve daha kısa sürede daha fazla kar elde etme sürecini hızlandırmak için kullanıldı. Bu, bazı küçük fabrikalarda vicdansız bir uygulamaydı, ancak Çin'de yaygınlaştı ve skandal 2013'te yaygınlaştıktan sonra birçok dürüst üreticiyi kutularına "kurşunsuz" olarak etiket basmaya zorladı.
Toz halinde litarj formunda, yaldız yapımında kullanılan hava şartlarına dayanıklı bir haşıl oluşturmak için bezir yağı ile karıştırılıp kaynatılabilir. Litarj, altın varağa sıcak ve parlak görünmesini sağlayan koyu kırmızı bir renk verirken, bezir yağı yapışma ve dayanıklı düz bir ciltleme yüzeyi sağlar.
PbO organik sentezde, belirli kondenzasyon reaksiyonlarında kullanılır.[12]
PbO, Plumbikon adı verilen bir video kamera tüpündeki giriş fotoiletkenidir.
Sağlık sorunları
Kurşun oksit solunduğunda veya yutulduğunda ölümcül olabilir. Deride, gözlerde ve solunum yolunda tahrişe neden olur. Diş eti dokusunu, merkezi sinir sistemini, böbrekleri, kanı ve üreme sistemini etkiler. Bitkilerde ve memelilerde biyolojik birikmeye uğrayabilir.[13]
Kaynakça
- Blei(II)-oxid. Merck
- Şablon:Ullmann
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd bas.). Butterworth-Heinemann. ISBN 0080379419.
- Abdel-Rehim, A. M. (2006). "Thermal and XRD analysis of Egyptian galena". Journal of Thermal Analysis and Calorimetry. 86 (2): 393-401. doi:10.1007/s10973-005-6785-6.
- Lead Processing @ Universalium.academic.ru 24 Temmuz 2020 tarihinde Wayback Machine sitesinde arşivlendi.. Alt address: Lead processing @ Enwiki.net 22 Şubat 2017 tarihinde Wayback Machine sitesinde arşivlendi..
- Şablon:Wells5th
- A simple example is given in Anil Kumar De (2007). "§9.2.6 Lead (Pb): Lead Monoxide PbO". A Textbook Of Inorganic Chemistry. New Age International. s. 383. ISBN 978-81-224-1384-7. A more complex example is in Turova, N.Y. (2002). "§9.4 Germanium, tin, lead alkoxides". The Chemistry of Metal Alkoxides. Springer. s. 115. ISBN 978-0-7923-7521-0. 16 Ocak 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ağustos 2020.
- Rowe, David John (1983). Lead Manufacturing in Britain: A History. Croom Helm. s. 16. ISBN 978-0-7099-2250-6.
- Şablon:Holleman&Wiberg
- Chapter 9, "Lead Compounds", in the book Ceramic and Glass Materials: Structure, Properties and Processing 2 Aralık 2017 tarihinde Wayback Machine sitesinde arşivlendi., published by Springer, year 2008.
- Şablon:Ullmann
- Şablon:OrgSynth
- "Lead(II) oxide". International Occupational Safety and Health Information Centre. 15 Aralık 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Haziran 2009.
Dış bağlantılar
- Case Studies in Environmental Medicine - Lead Toxicity5 Haziran 2009 tarihinde Wayback Machine sitesinde arşivlendi.
- ToxFAQs: Lead4 Şubat 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- National Pollutant Inventory - Lead and Lead Compounds Fact Sheet
- Webelements PbO 27 Temmuz 2020 tarihinde Wayback Machine sitesinde arşivlendi.
