Klorometan
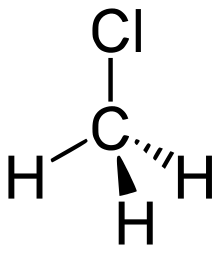
Klorometan, ya da metil klorür, CH3Cl formülüne sahip bir alkil halojenürdür. Aşırı derecede yanıcı bir gazdır. Önceden soğutucularda kullanılmıştır ancak toksisitesinden dolayı artık tüketici ürünlerinde kullanılmamaktadır. Klorometan ilk olarak Jean-Baptiste Dumas ve Eugene Peligot isimli iki Fransız kimyager tarafından 1835'te metanol, sülfürik asit ve sodyum klorür karışımının kaynatılması ile sentezlenmiştir, bu yöntem günümüzde kullanılana çok benzerdir.
| Klorometan | |
|---|---|
 | |
Chloromethane | |
Klorometan | |
Diğer adlar Metil klorür, monoklorometan | |
| Tanımlayıcılar | |
| Kısaltmalar | R-40 |
| CAS numarası | 74-87-3 |
| UN numarası | 1063 |
| SMILES |
|
| Özellikler | |
| Kimyasal formül | CH3Cl |
| Molekül kütlesi | 50,49 g mol−1 |
| Görünüm | renksiz gaz |
| Yoğunluk | 1,003 g/mL (-23,8°C, sıvı) 2,3 g/mL (gaz) |
| Erime noktası |
-97,4°C |
| Kaynama noktası |
-23,8°C |
| Tehlikeler | |
| NFPA 704 |
 4
2
0
|
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Benzen, etanol ve karbon tetraklorürde çözünür. Kloroform ve eterle karışabilir. Uygun saklama koşullarında stabildir. Güçlü UV ışığı hava ve nemde hidrojen klorür, karbon monoksit, karbon dioksit ve fosgene parçalanabilir. Neme maruz kalırsa metanol ve hidrojen klorüre parçalanabilir. Klorometan, alüminyum, magnezyum, çinko ve bazı tür plastiklere zarar verebilir. Ayrıca klorometan, metandan türemiş alkil klorürlere verilen addır, diklorometan, Triklorometan ve tetraklorometan.
Üretilişi
Genelde klorometan, metanol ile hidrojen klorürün tepkimesi ile üretilir. CH3OH + HCl → CH3Cl + H2O
Eğer diklorometan, kloroform ve karbon tetraklorürün de üretimi istenilirse klorometan, metan ve klor karışımının 400 °C'ye kadar ısıtılması ile de üretilir.
Güvenlik
Klorometan gazının solunması uyuşturucu etkisine benzer bir etkiye sebep olur. Klorometana mazur kalma uyuşukluk, baş dönmesi, şaşkınlık ya da nefes alma, konuşma ve yürümede zorlanmaya sebep olabilir. Yüksek konsantrasyonlarda felç, nöbet ve komaya bile sebep olabilir. Hava yerine solunursa boğabilir. Sıvı klorometan ile etkileşim cildi dondurabilir.
Kaynakça
- US National Library of Medicine'de chloromethane14 Mayıs 2019 tarihinde Wayback Machine sitesinde arşivlendi. (İngilizce)