Florokarbon
Florokarbonlar, bazen perflorokarbon veya PFC olarak da anılır, CxFy formülüne sahip organoflorin bileşiklerdir. Sadece karbon ve flor içerirler [1] fakat terminoloji her zaman çok sıkı takip edilmemektedir.[2] Perfloro- ön ekine sahip bileşikler, heteroatomlu olanlar da dahil olmak üzere hidrokarbonlardır, burada tüm CH bağları CF bağlarıyla değiştirilmiştir.[3] Florokarbonlar perfloroalkanlar, floroalkenler ve floroalkinler ve perfloroaromatik bileşikler olabilir. Florokarbonlar ve bunların türevleri floropolimerler, soğutucular, çözücüler ve anestezikler olarak kullanılır.

Perfloroalkanlar
Kimyasal özellikler
Perfloroalkanlar, organik kimyadaki en güçlü bağlardan biri olan karbon-flor bağının gücü nedeniyle çok kararlıdır.[4] Gücü, florun elverişli kovalent etkileşimler yoluyla bağı kısaltan ve güçlendiren karbon ve flor atomları üzerindeki kısmi yüklerle kısmi iyonik karakter kazandıran elektronegatifliğinin bir sonucudur. Ek olarak, çoklu karbon-flor bağları, karbonun daha yüksek bir pozitif kısmi yüke sahip olması nedeniyle, aynı ikiz karbon üzerindeki yakındaki diğer karbon-flor bağlarının gücünü ve dengesini arttırır.[2] Ayrıca, çoklu karbon-flor bağları aynı zamanda "iskelet" karbon-karbon bağlarını indükleyici etkiden güçlendirir.[2] Bu nedenle, doymuş florokarbonlar, karşılık gelen hidrokarbon emsallerinden ve hatta başka herhangi bir organik bileşikten kimyasal ve termal olarak daha kararlıdır. Çok güçlü indirgeyiciler tarafından saldırıya açıktırlar; örneğin Birch indirgemesi ve çok özel organometalik kompleksler.[5]
Florokarbonlar renksizdir ve suyun iki katından fazlasına kadar yüksek yoğunlukludur. Çoğu organik çözücü ile karışmaz (örneğin, etanol, aseton, etil asetat ve kloroform), ancak bazı hidrokarbonlarla (örneğin bazı durumlarda heksan) karışabilir. Suda çok düşük çözünürlüğe sahiptirler ve su da florokarbonlar içinde çok düşük bir çözünürlüğe sahiptir (10 ppm). Kırılma indisleri düşüktür.
Kutuplaş bağında kısmi yükler |
Florun yüksek elektronegatifliği , atomun polarize edilebilirliğini azalttığı için,[2] florokarbonlar, polar moleküller arası etkileşim temelini oluşturan uçucu dipollere zayıf şekilde duyarlıdır. Sonuç olarak, florokarbonlar düşük moleküller arası çekici kuvvetlere sahiptir ve hidrofobik ve apolar olmalarına ek olarak lipofobiktirler. Zayıf moleküller arası kuvvetlere sahip bu bileşikler, benzer kaynama noktalarına sahip, düşük yüzey gerilimi ve düşük buharlaşma sıcaklıklarına sahip sıvılarla karşılaştırıldığında düşük akmazlık (viskozite) sergiler. Florokarbon sıvılardaki düşük çekici kuvvetler onları sıkıştırılabilir (düşük kütle modülü) ve gazı nispeten iyi bir şekilde çözebilir hale getirir. Küçük florokarbonlar son derece uçucudur .[2] Beş perfloroalkan gazı vardır: tetraflorometan (kn −128 °C), hegzafloroetan (kn −78.2 °C), oktafloropropan (kn −36.5 °C), perfloro-n-bütan (kn 2.2 °C) ve perfloro-izo-bütan (kn −1 °C). Neredeyse tüm diğer floroalkanlar sıvıdır; En dikkat çeken istisna, 51 °C'de süblime olan perflorosikloheksandır.[6] Florokarbonlar ayrıca düşük yüzey enerjilerine ve yüksek dielektrik dayanıma sahiptir.[2]
- Perfluoroalkanes
 En basit perfloroalkan olan karbon tetraflorür
En basit perfloroalkan olan karbon tetraflorür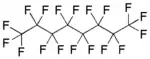 Perflorooktan , doğrusal bir perfloroalkan
Perflorooktan , doğrusal bir perfloroalkan.svg.png.webp) Perfluoro-2-metilpentan , dallı perfloroalkan
Perfluoro-2-metilpentan , dallı perfloroalkan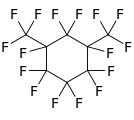 Perfliko-l , 3-dimetilsikloheksan , siklik bir perfloroalkan
Perfliko-l , 3-dimetilsikloheksan , siklik bir perfloroalkan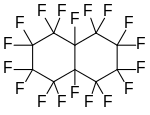 Perfluorodekalin , bir polisiklik perfloroalkan
Perfluorodekalin , bir polisiklik perfloroalkan
Yanıcılık
1960'larda anestetik olarak florokarbonlara büyük ilgi vardı. Araştırma hiçbir sonuca varmadı, ancak yanıcılığın hayatiliği konusunda oldukça çaba harcandı ve test edilen florokarbonların, çoğu temiz oksijen ve temiz azot oksit (anesteziyolojideki önemli gazlar) gazları olmasına rağmen herhangi bir oranda yanıcı olmadığını gösterdi.[7][8]
| Bileşik | Test koşulları | Sonuç |
|---|---|---|
| Heksafloroetan | Oksijende düşük yanma sınırı | Yok |
| Perfloropentan | Havadaki parlama noktası | Yok |
| Oksijendeki parlama noktası | -6 °C | |
| Azot oksitteki parlama noktası | -32 °C | |
| Perflorometilsikloheksan | Havada alt alevlenme sınırı | Yok |
| Oksijende alt yanma sınırı | % 8.3 | |
| Oksijende alt alevlenme sınırı (50 °C) | % 7.4 | |
| Azot oksitte alt yanma sınırı | % 7.7 | |
| Perfloro-1,3-dimetilsikloheksan | Oksijende alt alevlenme sınırı (50 °C) | % 5.2 |
| Perflorometildekalin | Kendiliğinden ateşleme testi 127 barda oksijen ile | 500'de ateşleme yok °C |
| Oksijende adyabatik şok dalgasında kendiliğinden tutuşma, 0,98 - 186 bar | Ateşleme yok | |
| Oksijende adyabatik şok dalgasında kendiliğinden tutuşma, 0,98 - 196 bar | Ateşleme |
1993'te 3M, florokarbonları CFC'lerin yerine yangın söndürücü olarak düşündü.[9] Yangından ısı alan, yüksek ısı kapasiteleri sebebiyle bu yangın söndürme etkisi düşünülmüştür. Bir uzay istasyonunda veya benzerinde kayda değer miktarda perflorokarbon içeren bir atmosferin yangınları tamamen önleyeceği önerilmiştir.[10][11] Yanma meydana geldiğinde, karbonil florür, karbon monoksit ve hidrojen florür dahil toksik dumanlar çıkar.
Gaz çözme özellikleri
Perflorokarbonlar göreceli olarak yüksek hacimli gazları çözer. Gazların yüksek çözünürlüğü, bu florokarbon akışkanlardaki zayıf moleküller arası etkileşimlere bağlanır.[12]
Tablo mol fraksiyon değerlerini gösterir, x1, 298.15 °K (25 °C), 0.101325 M Pa'da çözünmüş azot miktarını Ostwald katsayısından hesaplamaktadır.[13]
| Sıvı | 10 4 x 1 | Konsantrasyon, mM |
|---|---|---|
| Su | 0,118 | 0.65 |
| Etanol | 3.57 | 6.12 |
| aseton | 5.42 | 7.32 |
| Tetrahidrofuran | 5.21 | 6,42 |
| Sikloheksan | 7.73 | 7.16 |
| Perflorometilsikloheksan | 33.1 | 16.9 |
| Perfloro-1,3-dimetilsikloheksan | 31.9 | 14.6 |
Üretim
Florokarbon endüstrisinin gelişimi, II . Dünya Savaşı ile aynı zamana denk geldi.[14] Bundan önce, florokarbonlar, florun hidrokarbonla, yani doğrudan florizasyonla reaksiyonuyla hazırlandı. CC bağları flor ile kolayca parçalandığından, doğrudan florlama çoğunlukla tetraflorometan, heksafloroetan ve oktafloropropan gibi daha küçük perflorokarbonlar verir.[15]
Fowler süreci
Büyük ölçekli florokarbon üretimine izin veren önemli bir buluş, Fowler süreci idi. Bu işlemde, kobalt triflorür florin kaynağı olarak kullanılır. Örnek, perfloroheksanın sentezidir:
- C6H14 + 28 CoF3 → C6F14 + 14 HF + 28 CoF2
Elde edilen kobalt diflorür daha sonra bazen ayrı bir reaktörde yeniden üretilir:
- 2 CoF2 + F2 → 2 CoF3
Endüstriyel olarak, her iki adım, örneğin F2 kimyasalları Ltd tarafından üretilen Flutec yelpazesindeki flüorokarbonların imalatında, dikey karıştırılmış yataklı bir reaktör kullanılarak, altta hidrokarbon sokulmuş ve flüor reaktörün yarısına kadar sokulmuş olarak birleştirilmiştir. Florokarbon buharı üstten geri kazanılır.
Elektrokimyasal florlama
Elektrokimyasal florlama (ECF) (ayrıca Simons işlemi olarak da bilinir), hidrojen florür içinde çözünmüş bir substratın elektrolizini içerir. Florun kendisi, hidrojen florürün elektroliziyle üretildiği için ECF, florokarbonlara daha doğrudan bir yoldur. İşlem düşük voltajda (5 - 6 V) ilerler, böylece serbest flor serbest kalır. Substrat seçimi ideal olarak, hidrojen florür içerisinde çözünmesi gerektiği için sınırlandırılır. Eterler ve üçüncül aminler tipik olarak kullanılır. Perfloroheksan yapmak için, triheksilamin kullanılır, örneğin:
- N(C6H13)3 + 45 HF → 3 C6F14 + NF3 + 42 H2
Perflorlanmış amin ayrıca üretilecektir:
- N (C6H13)3 + 39 HF → N(C6F13)3 + 39 H2
Çevresel ve sağlık sorunları
Floroalkanlar genellikle atıl ve toksik değildir.[16][17][18]
Floroalkanlar, klor veya brom atomları içermediklerinden ozon tabakasına zarar vermezler ve bazen ozon tabakasına zarar veren kimyasal maddelerin yerine kullanılırlar.[19] Florokarbon terimi, ozon tabakasına zarar veren kloroflorokarbonlar dahil olmak üzere flor ve karbon içeren herhangi bir kimyasal maddeyi içermek için oldukça gevşek kullanılır. Floroalkanlann bazen önemli derecede biyoakümüle olan florosürfaktanlar ile karıştırılmamalıdır. Perfloroalkanlar biyolojik olarak birikmez; tıbbi prosedürlerde kullanılanlar, esasen buhar basıncının bir fonksiyonu olarak atılma oranıyla sona erme yoluyla vücuttan atılır; oktafloropropan için yarı ömür 2 dakikadan azdır, perflorodekalin için bu yaklaşık bir haftadır.[20][21]
Düşük kaynama noktalı perfloroalkanlar, kısmen çok uzun atmosferik ömürleri nedeniyle, güçlü sera gazlarıdır ve kullanımları Kyoto Protokolü tarafından kapsanmaktadır.[22]
Alüminyum eritme endüstrisi, elektroliz işleminin yan ürünü olarak üretilen atmosferik perflorokarbonların (özellikle tetraflorometan ve heksafloroetan ) temel bir kaynağı olmuştur.[23] Bununla birlikte, sanayi son yıllarda emisyonların azaltılmasında aktif olarak yer almaktadır.[24]
Uygulamalar
Tepkisiz (inert) oldukları için, perfloroalkanların esasen kimyasal kullanımı yoktur, ancak fiziksel özellikleri birçok farklı uygulamada kullanılmasına neden olmuştur. Bunlar şunları içerir:
- Perflorokarbon izleyici
- Sıvı dielektrik
- Kimyasal buhar birikimi
- Organik Rankine çevrimi
- Florlu çifte fazlı kataliz [25]
- Kozmetikler [26]
Birkaç tıbbi kullanımı:
Floroalkenler ve floroalkinler
Doymamış flüorokarbonlar, flüoroalkanlardan çok daha reaktifdir. Difloroasetilen kararsız olmasına rağmen (ilgili alkinler için tipik olduğu gibi, dikloroasetilene bakınız),[2] heksafloro-2-butin ve ilgili florin alkinler iyi bilinmektedir.
- Doymamış flüorokarbonlar
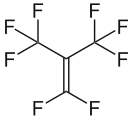 Perfloroizobuten, bir reaktif ve son derece toksik floralken gaz
Perfloroizobuten, bir reaktif ve son derece toksik floralken gaz Tetrafloroetilen, önemli bir perflorlanmış monomer.
Tetrafloroetilen, önemli bir perflorlanmış monomer.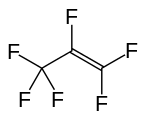 Hegzafloropropilen, bir diğer önemli perfloroalken.
Hegzafloropropilen, bir diğer önemli perfloroalken.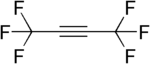 Hegzafloro-2-bütin , bir perfloroalkin.
Hegzafloro-2-bütin , bir perfloroalkin.
Polimerizasyon
Floroalkenler, normal alkenlerden daha ekzotermik olarak polimerize olur.[2] Doymamış florokarbonların, elektronegatif flor atomlarının düşük s karakterli orbitallerinin daha fazla bağ elektronu paylaşma arayışı sebebiyle, sp3 hibridizasyonuna yönelik bir tahrik kuvveti vardır.[2] Bu sınıfın en ünlü üyesi,Teflon ismi altında daha iyi bilinen politetrafloroetilen (PTFE) üretiminde kullanılan tetrafloroetilendir .
Çevresel ve sağlık sorunları
Floroalkenler ve florlu alkinler reaktifdir ve çoğu, perfloroizobüten gibi toksiktir. Floroalkenler, klor veya brom atomları içermediklerinden ozon tabakasına zarar vermezler. Sera gazları olamayacak kadar reaktifler. Politetrafloroetilen üretmek için biyoakümülasyon yapan çeşitli florlu yüzey aktif cisimleri kullanılır.
Perfloroaromatik bileşikler
Perfloroaromatik bileşikler, diğer florokarbonlar gibi sadece karbon ve flor içerir, fakat aynı zamanda bir aromatik halka içerir. En önemli üç örnek, hekzaflorobenzen, oktaflorotolüen ve oktafloronaftalendir.
- Perfluoroaromatic compounds
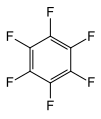 Hekzaflorobenzen
Hekzaflorobenzen
Perfloroaromatik bileşikler, floroalkanlar gibi Fowler işlemi yoluyla üretilebilir, ancak tam florlanmayı önlemek için koşullar ayarlanmalıdır. Ayrıca karşılık gelen perkloroaromatik bileşiğin potasyum florür ile yüksek sıcaklıkta ısıtılmasıyla da yapılabilir (tipik olarak 500 °C) klor atomlarının yerini flor atomları alır. Üçüncü bir yol, floroalkanın deflorizasyonudur; örneğin, oktaflorotoluen, perflorometilsikloheksandan Nikel veya demir katalizör ile 500 °C'ye ısıtılarak yapılabilir.[29]
Perfloroaromatik bileşikler aşağıdaki tabloda gösterildiği gibi, karşılık gelen aromatik bileşiğe benzer erime ve kaynama noktalarına sahip moleküler ağırlıkları için nispeten uçucudur. Yoğunluğu yüksektir ve yanıcı değildir. Çoğunlukla berrak, renksiz sıvılardır (sarı bir katı olan oktafloronaftalen bir istisnadır). Perfloralkanların aksine, genel çözücüler ile karışabilir olma eğilimindedirler.
| Bileşik | Erime noktası, °C | Kaynama noktası, °C |
|---|---|---|
| Hekzaflorobenzen | 5.3 | 80.5 |
| Benzen | 5.5 | 80.1 |
| Oktaflorotoluen | <-70 | 102-103 |
| Toluen | -95 | 110.6 |
| Perfloro (etilbenzen) | - | 114-115 |
| Etilbenzen | -93,9 | 136.2 |
| Oktafloronafthalin | 86-87 | 209 [30] |
| Naftalin | 80.2 | 217.9 |
Ayrıca bakınız
- Kategori: Florokarbonlar
- Florokimya endüstrisi
- Fluorografen
- Perflorosikloalken (PFCA)
Kaynakça
- IUPAC, Compendium of Chemical Terminology, 2. basım (the "Gold Book") (1997). Düzeltilmiş çevrimiçi sürümü: (2006-) "fluorocarbons".
- Lemal DM (January 2004). "Perspective on fluorocarbon chemistry". J. Org. Chem. 69 (1): 1–11. doi:10.1021/jo0302556. PMID 14703372.
- Murphy WJ (March 1947). "Fluorine Nomenclature... A statement by the Editors". Ind. Eng. Chem. 39 (3): 241–242. doi:10.1021/ie50447a004.
- O'Hagan D (February 2008). "Understanding organofluorichemistry. An introduction to the C–F bond". Chem. Soc. Rev. 37 (2): 308–19. doi:10.1039/b711844a. PMID 18197347.
- Kiplinger JL, Richmond TG, Osterberg CE (1994). "Activation of Carbon-Fluorine Bonds by Metal Complexes". Chem. Rev. 94 (2): 373–431. doi:10.1021/cr00026a005.
- "Archived copy" (PDF). Archived from the original (PDF) on 2008-12-05. Retrieved 2008-11-29.
- Larsen ER (1969). "Fluorine Compounds in Anesthesiology: VI Flammability". Fluorine Chem. Rev. 3: 22–27.
- Flutec (Technical report). ISC Chemicals Limited. 1982.
- John A. Pignato, Jr.; Paul E. Rivers; Myron T. Pike. "Development of Perfluorocarbons As Clean Extinguishing Agents" (PDF). National Institute of Standards and Technology. Archived from the original (PDF) on 2014-05-21. Retrieved 2019-01-03.
- McHale ET (1974). "Life Support Without Combustion Hazards". Fire Technology. 10 (1): 15–24. doi:10.1007/bf02590509.
- Huggett C (1973). "Habitable Atmospheres Which Do Not Support Combustion". Combustion and Flame. 20: 140–142. doi:10.1016/s0010-2180(73)81268-4.
- "Dissolving gases in FLUTEC™ liquids" (PDF). F2 Chemicals Ltd. 10 May 2005.
- Battino R, Rettich TR, Tominaga T (1984). "The solubility of nitrogen and air in liquids". J. Phys. Chem. Ref. Data. 13 (2): 308–19.
- McBee ET (March 1947). "Fluorine Chemistry". Ind. Eng. Chem. 39 (3): 236–237. doi:10.1021/ie50447a002.
- Siegemund G, Schwertfeger W, Feiring A, Smart B, Behr F, Vogel H, McKusick B "Fluorine Compounds, Organic" in "Ullmann's Encyclopedia of Industrial Chemistry" 2005, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a11_349
- "Arşivlenmiş sayfa". 24 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Eylül 2015.
- "HPV Robust Summaries and Test Plan" (PDF). Internet Archive. Archived from the original (PDF) on 2012-12-02. Retrieved 2019-01-03.
- Yamanouchi K; Yokoyama K (1975). "Proceedings of the Xth International Congress for Nutrition: Symposium on Perfluorochemical Artificial Blood, Kyoto": 91.
- "Arşivlenmiş kopya". 19 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Mayıs 2014.
- Platts DG; Fraser JF (2011). "Critical Care and Resuscitation". 13(1): 44–55.
- Geyer RP (1975). "Proc. Xth Intern. Congress for Nutr.: Symp on Perfluorochemical Artif. Blood, Kyoto": 3–19.
- Change, United Nations Framework Convention on Climate. "Kyoto Protocol". unfccc.int. Retrieved 2017-09-27.
- "The Anode Effect 22 Şubat 2019 tarihinde Wayback Machine sitesinde arşivlendi.". aluminum-production.com.
- Arşivlenmiş bağlantı climatevision.gov
- "Arşivlenmiş dosya" (PDF). 7 Şubat 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 7 Şubat 2014.
- Ralph Hill. "Flourinated Oils in Cosmetics 27 Şubat 2019 tarihinde Wayback Machine sitesinde arşivlendi.". beautymagonline.com.
- Imamura Y; Minami M; Ueki M; Satoh B; Ikeda T (2003). "Use of perfluorocarbon liquid during vitrectomy for severe proliferative diabetic retinopathy 20 Nisan 2020 tarihinde Wayback Machine sitesinde arşivlendi.". Br J Ophthalmol. 87 (5): 563–566. doi:10.1136/bjo.87.5.563. PMC 1771679. PMID 12714393.
- "Arşivlenmiş dosya" (PDF). 19 Mayıs 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 19 Mayıs 2014.
- Banks, RE (1970). Fluorocarbons and their Derivatives, Second Edition. London: MacDonald & Co. (Publishers) Ltd. pp. 203–207. ISBN 978-0-356-02798-2.
- "Octafluoronaphthalene 5 Şubat 2019 tarihinde Wayback Machine sitesinde arşivlendi.". ChemSpider.
Dış bağlantılar
- Avrupa Florokarbonlar Teknik Komitesi tarafından önerilen Florokarbonlar ve Sülfür Heksaflorür,20 Ocak 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Vega Science Trust tarafından sağlanan CFC'ler ve Ozon Tükenmesi8 Şubat 2007 tarihinde Wayback Machine sitesinde arşivlendi. Freeview videosu.
- Floropolimerlere giriş
- Organofluorine kimyası Graham Sandford