Azot pentaoksit
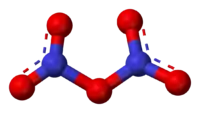
Azot pentaoksit N2O5 formüllü kimyasal bileşik. Diazot pentaoksit olarak da bilinir. Sadece azot ve oksijen içeren azot oksit ailesinin ikili bileşiklerinden biridir. Kararsız ve potansiyel oksitleyicidir.
| Azot pentaoksit | |
|---|---|
 | |
 | |
Diazot pentaoksit | |
Diğer adlar Nitrik anhidrat Nitronyum nitrat Nitril nitrat DNPO Anhidrit nitrik asit | |
| Tanımlayıcılar | |
| CAS numarası | 10102-03-1 |
| PubChem | 66242 |
| EC numarası | 233-264-2 |
| ChEBI | 29802 |
| SMILES |
|
| InChI |
|
| ChemSpider | 59627 |
| Özellikler | |
| Molekül formülü | N2O5 |
| Molekül kütlesi | 108.01 g/mol |
| Görünüm | Beyaz katı |
| Yoğunluk | 1.642 g/cm3 (18 °C) |
| Erime noktası |
41 C[1] |
| Kaynama noktası |
47 C (Süblimleşir) |
| Çözünürlük (su içinde) | Nitrik asit oluşturmak için su ile reaksiyona girer. |
| Çözünürlük () | kloroformda çözünür. CCl4 de umusanacak kadar az çözünür. |
| Tehlikeler | |
| Ana tehlikeler | Güçlü oksitleyicidir ve su ile etkileşiminden güçlü asitler oluşturur. |
| NFPA 704 |
 0
3
0
OX
|
| Parlama noktası | Tutuşmaz |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
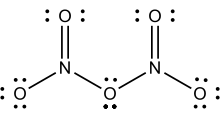
N2O5 duruma göre iki yapı edinen bileşilere nadir bir örnektir.Çoğunlukla bir tuzdur fakat bazı koşullarda bir polar moleküldür:
- [NO2+][NO3−] ⇌ N2O5
Sentezi ve özellikleri
N2O5 ilk kez, Deville tarafından,1840'ta rapor edilmiştir. Deville bu bileşiği AgNO3 ile Cl2 tepkimesi ile elde etmiştir.[2][3] Tavsiye edilen laboratuvar sentezi A recommended laboratory synthesis entails dehydrating nitrik asiti (HNO3) fosfor(V) oksit ile dehidrate etmektir:[4]
- P4O10 + 12 HNO3 → 4 H3PO4 + 6 N2O5
Tersi işlemde, N2O5 ile su nitrik asit elde etmek için reaksiyona girer. Yani, azot pentaoksit nitrik asitin anhidratıdır:
- N2O5 + H2O → 2 HNO3
N2O5 oda sıcaklığında hafifçe süblimleşen renksiz kristal halindedir.Bu tuz oda sıcaklığında NO2 ve O2 bileşenlerine ayrışır. [5]
Kaynakça
- Emeleus (1 Ocak 1964). Advances in Inorganic Chemistry. Academic Press. ss. 77-. ISBN 978-0-12-023606-0. Erişim tarihi: 20 Eylül 2011.
- M.H. Deville (1849). "Note sur la production de l'acide nitrique anhydre". Compt. Rend. Cilt 28. ss. 257-260.
- Jai Prakash Agrawal (19 Nisan 2010). High Energy Materials: Propellants, Explosives and Pyrotechnics. Wiley-VCH. s. 117. ISBN 978-3-527-32610-5. Erişim tarihi: 20 Eylül 2011.
- Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- Nitrogen(V) Oxide. Inorganic Syntheses. 3. 1950. ss. 78-81.