Asetonitril
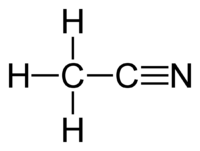
Asetonitril (ACN ya da MeCN) formülü CH3CN olan bir kimyasal bileşiktir. Bu renksiz sıvı en basit organik nitril ve en yoğun kullanılan çözücüdür. Siyano grubuna metil kökü bağlanmasıyla oluşur. Bu yüzden metil siyanür de denebilir. Akrilonitril üretiminde yan ürün olarak ortaya çıkmaktadır.
| Asetonitril | |
|---|---|
 | |
 | |
Asetonitril | |
Etannitril | |
Diğer adlar
| |
| Tanımlayıcılar | |
| CAS numarası | 75-05-8 |
| PubChem | 6342 |
| EC-numarası | 200-835-2 |
| UN numarası | 1648 |
| SMILES |
|
| Gmelin veritabanı | 895 |
| Özellikler | |
| Kimyasal formül | C2H3 |
| Molekül kütlesi | 27,05 g mol−1 |
| Görünüm | renksiz sıvı |
| Yoğunluk | 0,786 |
| Erime noktası |
-46~-44°C |
| Kaynama noktası |
81,3~82,1°C |
| Asitlik (pKa) | 25 |
| Baziklik (pKb) | -11 |
| Benzeyen bileşikler | |
Benzeyen bileşikler |
*Akrilonitril |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Üretimi
Asetonitril, akrilonitrilin üretimi sırasında çıkan bir yan üründür.[1] Asetonitrilin üretim eğrileri akrilonitrilkileri takip eder. Asetonitril aynı zamanda karbon monoksit, amonyak, ve hidrojen gazları ile tepkimesiyle de üretilebilmektedir.[2] ABD’de asetonitrilin dört ana üreticisi : INEOS, DuPont, J.T. Baker Chemical, ve Sterling Chemicals'tır. 1992’de ABD’de 14,700 ton asetonitril üretilmiştir.
Uygulamalar
Çözücü
Asetonitril bütadienin saflaştırılmasında çözücü olarak kullanılmaktadır. 2000 öncesinde oje çıkarıcıların formüllerinde; aseton ve etil asetat gibi kullanılmaktaydı. Daha özgün uygulamalarda, sıklıkla bilinmeyen bir kimyasal tepkimenin denenmesinde sık kullanılan bir seçenektir. Uygun sıvı genişliği ile polardır (3.84 D). Düşük asidik özelliği sayesinde sorun çıkarmadan geniş bir bileşik yelpazesini çözer. Bu nedenden dolayı HPLC’de (yüksek performans sıvı kromatografisi) hareketli bir faz olarak yoğun bir kullanımı söz konusudur. Benzer şekilde döngüsel voltametrede görece yüksek dielektrik sabiti nedeniyle çok kullanılan bir çözücüdür. Asetonun özellikleri de benzerdir ancak bazlara ve nükleofillere karşı yüksek oranda tepkilidir.
Organik bireşim
Asetonitril, zirai ilaçlardan parfüm yapımına kadar organik bireşimde iki karbon yapıcı bloktur.[3] Siyanojen klorür ile tepkimesi malononitrili meydana getirir.
İnorganik kimyada ligand olarak
İnorganik kimyada, asetonitril değiştirilebilir ligand olarak geniş bir kullanıma sahiptir. Buna güzel bir örnek; asetonitrilde (polimerik) paladyum klorür süspansiyonunu ısıtarak hazırlanan PdCl2(MeCN)2'un kullanımıdır
- [PdCl2]n + 2n MeCN → n PdCl2(MeCN)2
Güvenlik
Asetonitril düşük bir toksisiteye sahiptir, fareler için LD50 3.8 g/kg'dır. Diğer nitrillerin aksine asetonitril metabolizmada siyanür vermez.[1]
Dipnotlar
- Peter Pollak, Gérard Romeder, Ferdinand Hagedorn, Heinz-Peter Gelbke "Nitriles" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002: Weinheim. DOI: 10.1002/14356007.a17_363
- Şablon:Ref patent
- Şablon:OrgSynth
