Hidrojen siyanür
Hidrojen siyanür (HCN), inorganik bir bileşiktir.[1] Gübrelemede, tekstil boya sanayinde, dezenfektan madde yapımında, fotoğrafçılıkta, gümüş temizlemede (gaz olarak); gemilerin, evlerin ve depoların zararlı etkenlerden kurtarılmasında kullanılan etkili bir bileşiktir. Hidrojen siyanür, 25 °C'de kaynayan renksiz acıbadem kokusunda bir sıvıdır. Buharı havadan hafiftir ve difüzyon kabiliyeti olduğundan, tavan ve duvarlardan geçebilir. Siyanolu hidrojenin, aldehit ve ketonlarla yaptığı siyanohidrin bileşikleri, bitkiler âleminde glukozit halinde bulunurlar. Organizmaya siyanür iyonu veririler ve siyanür zehirlenmelerine yol açarlar. 1 litre havada 1 mg HCN birkaç dakikada öldürebilir. Yetişkinde 50–60 mg HCN, 50-60 g şeftali çekirdeği, 50 g acıbadem veya acıbadem suyu (%0,1 HCN) yeterli öldürücü doz olarak bilinmektedir.
| Hidrojen siyanür | |
|---|---|
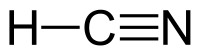 | |
 | |
Hydrogen Cyanide | |
| Tanımlayıcılar | |
| CAS numarası | 74-90-8 |
| PubChem | 768 |
| EC numarası | 200-821-6 |
| ChemSpider | 748 |
| Özellikler | |
| Molekül formülü | HCN |
| Molekül kütlesi | 27.0253 g/mol |
| Görünüm | Renksiz sıvı yada gaz |
| Koku | Acıbademe benzer |
| Yoğunluk | 1.52 g/cm³ |
| Erime noktası |
-13.29 °C |
| Kaynama noktası |
26 °C |
| Tehlikeler | |
| GHS piktogramları |     |
| NFPA 704 |
 4
4
2
|
| Parlama noktası | −17.8 °C |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Tabiatta; acıbadem, erik, şeftali çekirdeği, kayısı çekirdeği ve kiraz çekirdeğinde bulunmaktadır. Pamuk ve yünlerin yanmasından da ortaya çıkabilir.
Zehirlenme belirtileri ve seyri
Hidrojen siyanür, fizyolojik 7,4 pH'de yalnız %1,6 oranında çözünür. Bu nedenle gerek emilişi (deriden de öldürücü dozlarda emilebilir), gerekse vücut içi membranlardan geçişi ultra çabuk olduğundan, sitokromoksidazı (solunum sistemi enzimi) hemen bloke eder. HCN buharı solunur ise etkisi bir iki saniye içinde görülür. Havada litre başına 0,2-0,3 mg (180-270 ppm) HCN miktarı çabuk öldürücü olup, 0,1/1 mg'lık (=90ppm) miktarı ise daha uzun sürede ölüme yol açar. 0,02-0,04 mg/l'deki (18-36 ppm) konsantrasyonda uzun süre solumada etkisizdir.
Toksikolojik araştırma
Birkaç damla mide sıvısı kan ile muamele edilirse kanın rengi turuncu-kırmızı olur. Organlar asit tartarik ile birleştirilir, perklorür ayrıştırılıp ve HCl ile karıştırılırsa mavi renk görülür. Organlarda bulunan hidrojen siyanürün ölüm sebebi olarak kabul edilmesi için 5-10 santigram olması gerekmektedir.
Deneysel açıklama
Tartarik asitle asitlendirilmiş örnek bir balona konur ve balonun ağzına takılan bir mantar yardımıyla, önce %0,2’lik guayak tentürü, sonra %0,2’lik bakır sülfat çözeltisi ile emprenye edilmiş bir filtre kağıdı sallandırılır. HCN çıkıyorsa kağıdın rengi maviye döner.
Vücuttaki dönüşümü
Siyanür şiddetli biçimde oksijenli metabolizmayı bozar. Sitokrom oksidazdan, moleküler oksijen elektron taşıması bloke olur, çevresel oksijen gerilimi artar ve oksijenin hemoglobin tarafından bırakılması azalır. Aynı zamanda siyanür genellikle hızlı nefes alıp verme ile sonuçlanan atardamardaki kimyasal reseptörler daha fazla harekete geçer. Hasta merkezi solunum yetmezliğinden ölür. Bu HCN’in gaz olarak alınmasıyla gerçekleşir. Ağız yoluyla alındığında ise HCN ölümcül hale gelebilir. Ancak siyanür bakteri içeren glukosidaz tarafından bağırsaklar yoluyla atılabilir.
Mitokondri'de bulunuşu
Mitokondri ATP’nin üretimi için gereken yapıları ve enzimleri içerir. ATP elektron taşıma sistemi ile birleşmiş oksidatif fosforilasyon aracılığı ile sitrik asit çeviriminde üretilir. Mitokondri, metabolizmayı kontrol eden O2, su ve elektrolit dengesi, pH, ısı ve belli bazı mitokondrial reaksiyonların oluşması için gereken glikotik seviyeler gibi faktörlerin değişmesine duyarlıdır.
Mitokondrilerde bu bozucu değişiklikler yüzünden herhangi bir sistematik hücre yaralanmasında ikincil bir etkisi olarak ortaya çıkarlar. Bu sonuç olarak hücrede enerji gerektiren oluşumlar daha fazla ortaya çıkmasın diye ATP’nin oluşumunu bloke eder. Siyanür elektron taşıma sisteminin sitokrom oksidazını engeller, bu da stokromdan oksijene elektron taşınmasının kesintiye uğraması ve ATP oluşumunun bloke edilmesi anlamına gelir. Böylece hücre yeterli oksijeni alamayacak ve oksijen azlığından buna bağlı olarak da enerji eksikliğinden hücre ölecektir.
Kaynakça
- "İnorganik bileşikler, İngilizce". 24 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Mart 2014.
