Astatin
Astatin, simgesi At ve atom numarası 85 olan radyoaktif bir kimyasal elementtir. Sadece çeşitli ağır elementlerin ayrışma ürünü olarak ortaya çıkan, yer kabuğunda en nadir bulunan doğal elementtir. Astatinin tüm izotopları kısa ömürlüdür; en kararlı olanı, 8.1 saatlik bir yarı ömüre sahip astatin-210'dur. Saf elementin bir örneği asla monte edilmemiştir, çünkü herhangi bir makroskopik örnek kendi radyoaktivitesinin ısısı ile hemen buharlaştırılacaktır.
Astatinin yığın özellikleri kesin olarak bilinmemektedir. Birçoğu elementin periyodik tablodaki daha ağır bir iyot analogu ve halojenlerin bir üyesi (flor, klor, brom ve iyot içeren elementler grubu) konumuna göre tahmin edilmiştir. Astatinin koyu veya parlak bir görünüme sahip olması muhtemeldir ve yarı iletken veya metal olabilir; muhtemelen iyot değerinden daha yüksek bir erime noktasına sahiptir. Kimyasal olarak, birkaç anyonik astatin türü bilinmektedir ve bileşiklerinin çoğu iyota benzemektedir. Aynı zamanda, sulu çözelti içinde (daha hafif halojenlerin aksine) stabil bir monatomik katyon oluşturabilme de dahil olmak üzere bazı metalik davranışlar gösterir.
Elementin ilk sentezi 1940 yılında Berkeley'deki Kaliforniya Üniversitesi'nde, Dale R. Corson, Kenneth Ross MacKenzie ve Emilio G. Segrè tarafındandı. "Kararsız" anlamına gelen Yunan astatos' tan(ἄστατος) isimlendirildi. Dört astatin izotopunun doğal olarak meydana geldiği bulunmuştur, ancak yerkabuğunda herhangi bir zamanda bir gramdan daha az bulunur. Ne en kararlı izotop astatin-210, ne de tıbbi olarak yararlı astatin-211 doğal olarak meydana gelmez; sadece sentetik olarak, genellikle bizmut-209'u alfa parçacıklarıyla bombardıman ederek üretilebilirler.
Özellikler
Astatin son derece radyoaktif bir elementtir. Tüm izotoplarının yarı ömürü 8.1 saat veya daha azdır, diğer astatin izotopları, bizmut, polonyum veya radona ayrışır. İzotoplarının çoğu, bir saniye veya daha az yarı ömürleri ile çok kararsızlardır. Periyodik tablodaki ilk 101 elementten sadece fransiyum daha az kararlıdır ve fransiyumdan daha kararlı olan tüm astatin izotopları her durumda sentetiktir ve doğada meydana gelmez.[2]
Astatinin yığın özellikleri kesin olarak bilinmemektedir.[3] Araştırma, ağırlıklandırılabilir miktarların yaratılmasını önleyen kısa yarı ömrü ile sınırlıdır.[4] Görünür bir astatin parçası, yoğun radyoaktivitesinden kaynaklanan ısı nedeniyle hemen kendini buharlaştırır.[5] Yeterli soğuma ile makroskopik bir miktarda astatinin ince bir tabaka halinde birikip biriktirilemeyeceği görülmeye devam etmektedir.[6] Astatin genellikle ya ametal ya da bir metaloid olarak sınıflandırılır;[7][8] metal oluşumu da öngörülmüştür.[6][9]
Fiziksel
Astatinin fiziksel özelliklerinin çoğu, teorik veya ampirik olarak türetilmiş yöntemler kullanılarak (interpolasyon veya ekstrapolasyon yoluyla) tahmin edilmiştir.[10] Örneğin, halojenler atom ağırlığı arttıkça koyulaşır - flor neredeyse renksiz, klor sarı-yeşil, brom kırmızı-kahverengi ve iyot koyu gri/mor renktedir. Astatin bazen muhtemelen siyah bir katı (bu eğilimi takip ettiği varsayılarak) veya metalik bir görünüme (bir metaloid veya metal ise) sahip olarak tanımlanır.[11][12][13] Astatinin erime ve kaynama noktalarının da halojen serisinde görülen ve atom numarasıyla artmakta olan eğilimi izlemesi beklenmektedir. Bu temelde sırasıyla 575 ve 610 K (302 ve 337 °C; 575 ve 638 °F) olduğu tahmin edilmektedir.[14] Bazı deneysel kanıtlar, astatinin halojen eğiliminin ima ettiğinden daha düşük erime ve kaynama noktalarına sahip olabileceğini düşündürmektedir. 1982'de elementel astatinin kaynama noktasının kromatografik bir tahmini, 503±3 K (yaklaşık 230±3 °C veya 445±5 °F) bir kaynama noktası önerdi.[15] Astatin, daha düşük bir buhar basıncına sahip olan iyottan daha az süblimlidir.[4] Yine de, belirli bir miktar astatinin yarısı, oda sıcaklığında temiz bir cam yüzeye konulursa yaklaşık bir saat içinde buharlaşacaktır. Orta ultraviyole bölgesindeki astatinin emme spektrumu 224.401 ve 216.225 nm'de, 6p ila 7s geçişleri düşündüren çizgilere sahiptir.[16][17]
Katı astatinin yapısı bilinmemektedir.[18] Bir iyot analogu olarak, diyatomik astatin moleküllerinden oluşan ortorombik bir kristal yapıya sahip olabilir ve bir yarı iletken (0.7 eV bant aralığı ile) olabilir.[19] Alternatif olarak, yoğunlaştırılmış astatin tahmin edildiği gibi metalik bir faz oluşturursa, monatomik bir yüz merkezli kübik yapıya sahip olabilir; bu yapıda, iyotun benzer yüksek basınç fazı gibi bir süperiletken olabilir.[6] Diyatomik astatinin (At2) varlığına (veya aleyhine) dair kanıtlar seyrek ve sonuçsuzdur.[20][21][22][23][24] Bazı kaynaklar var olmadığını veya en azından hiç gözlemlenmediğini belirtirken,[25][26] diğer kaynaklar varlığını iddia eder veya ima eder.[15][27][28] Bu tartışmaya rağmen, diyatomik astatinin birçok özelliği tahmin edilmiştir;[24] örneğin, bağ uzunluğu 300 ± 10 pm, bağ ayrışma enerjisi 83.7 ± 12.5 kJ/mol[29] ve buharlaşma ısısı (∆Hvap) 54.39 kJ/mol olacaktır.[30] Son şekil, astatinin (en azından), sıvı halde ~42 kJ/mol'den daha yüksek olan elementlerin sıvı olduğunda metalik olması temelinde sıvı halde metalik olabileceği anlamına gelir;[31] 41.71 kJ/mol'lik bir değere sahip diyatomik iyot,[32] eşik değerinin hemen altına düşer.
Kimyasal
Astatin kimyası "astatin deneylerinin yapıldığı son derece düşük konsantrasyonlar ve safsızlıklar, duvarlar ve filtreler veya radyoaktivite yan ürünleri ve diğer istenmeyen nano ölçekli etkileşimlerle reaksiyon olasılığı" ile belirlenir.[19] Görünür kimyasal özelliklerinin çoğu, son derece seyreltik astatin çözeltileri,[28][33] tipik olarak 10−10 mol·L−1'den daha az olan izleyici çalışmaları kullanılarak gözlemlenmiştir.[34] Anyon oluşumu gibi bazı özellikler diğer halojenlerle aynı hizadadır.[4] Astatin bir katot üzerine kaplama, hidroklorik asit içinde metal sülfitler ile birlikte çökeltme ve sulu çözeltide stabil bir monatomik katyon oluşturma gibi bazı metalik özelliklere de sahiptir.[17][35] Bir metal şelat ajanı[36] olan EDTA ile kompleksler oluşturur ve antikor radyoaktif etiketlemesinde bir metal gibi davranabilir; bazı açılardan +1 durumunda astatin aynı durumda gümüşe benzer. Bununla birlikte, astatinin organik kimyasının çoğu, iyotun kimyasına benzer.[37]
Astatin, revize edilmiş Pauling ölçeğinde 2.2'lik bir elektronegatifliğe sahiptir – iyottan (2.66) daha düşük ve hidrojen ile aynıdır. Hidrojen astatitte (HAt), negatif yükün hidrojen atomu üzerinde olduğu tahmin edilir, bu da bileşiğin belirli isimlendirmelere göre astatin hidrür olarak adlandırılabileceğini ima eder.[38][39][40][41] Bu, Allred-Rochow ölçeğinde (1.9) astatinin elektronegatifliği ile hidrojenden (2.2) daha az olmasıyla tutarlı olacaktır.[42] Bununla birlikte, resmi IUPAC stokiyometrik terminoloji, elementlerin göreceli elektronegatifliklerinin sadece periyodik tablodaki konumları nedeniyle belirlenmesine yönelik ideal bir kurala dayanmaktadır. Bu sözleşmeye göre, astatin, gerçek elektronegatifliğinden bağımsız olarak hidrojenden daha elektronegatifmiş gibi ele alınır. Astatinin elektron afinitesinin, dönüş-yörünge etkileşimleri nedeniyle üçte bir oranında azaldığı tahmin edilmektedir.[34]
Bileşikler
İyottan daha az reaktif olan astatin, halojenlerin en az reaktifidir,[43] ancak bileşikleri mikroskopik miktarlarda sentezlenmiş ve radyoaktif parçalanmalarından önce mümkün olduğunca yoğun bir şekilde incelenmiştir. İlgili reaksiyonlar tipik olarak daha büyük miktarlarda iyot ile karıştırılmış seyreltik astatin çözeltileri ile test edilmiştir. Bir taşıyıcı olarak hareket eden iyot, laboratuvar tekniklerinin (filtrasyon ve çökeltme gibi) çalışması için yeterli malzeme olmasını sağlar.[44][45] İyot gibi, astatinin −1 ila +7 arasında değişen tek sayılı oksidasyon durumlarını benimsediği gösterilmiştir.
Sodyum,[5] paladyum, gümüş, talyum ve kurşun astatidleri formunda sadece birkaç metal bileşiği bildirilmiştir.[24] Gümüş ve sodyum astatidin ve diğer varsayımsal alkali ve toprak alkali astatidlerin bazı karakteristik özellikleri, diğer metal halojenürlerden ekstrapolasyon ile tahmin edilmiştir.
Astatin kimyasının öncüleri, genellikle hidrojen astatit olarak adlandırılan hidrojen ile bir astatin bileşiğinin oluşumuna dikkat çekti. Belirtildiği gibi, bunun yerine bu bileşiğe astatin hidrit olarak atıfta bulunmak için zeminler vardır. Kolayca oksitlenir; seyreltik nitrik asit ile asitleştirme, At0 veya At+ formlarını verir ve müteakip gümüş(I) ilavesi, en azından gümüş(I) astatit (AgAt) olarak astatini çökeltebilir. İyot, aksine, oksitlenmez ve gümüş(I) iyodür olarak kolayca çökelir.[4]
Astatinin bor,[46] karbon ve azota bağlandığı bilinmektedir.[23] At–B bağları ile çeşitli bor kafesi bileşikleri hazırlanmıştır, bunlar At–C bağlarından daha kararlıdır.[47] Astatin, astatobenzen (C6H5At) oluşturmak üzere benzen içindeki bir hidrojen atomunun yerine geçebilir; bu klor ile C6H5AtCl2'ye oksitlenebilir. Bu bileşiğin bir alkalin hipoklorit çözeltisi ile muamele edilmesi suretiyle C6H5AtO2 üretilebilir. Dipiridin-astatin(I) katyonu, [At(C5H5N)2]+, perklorat[23] (koordine edici olmayan bir anyon[48]) ve nitrat ile iyonik bileşikler oluşturur [At(C5H5N)2]NO3.[23] Bu katyon, iki daral kovalent bağın, astatin(I) merkezini azot atomları yoluyla piridin halkalarının her biri ile ayrı ayrı bağladığı bir koordinasyon kompleksi olarak bulunur.[23]
Oksijen ile, sulu çözeltideki AtO− ve AtO+ türlerinin, perklorik asit çözeltisinde sodyum persülfat ile astatinin elementel brom gibi bir oksidanla (veya son durumda) reaksiyona sokulmasıyla oluşturulan kanıtlar vardır.[4] Daha önce AtO2–2 olduğu düşünülen türlerin o zamandan beri AtO+'nın bir hidroliz ürünü olan be AtO(OH)-2 olduğu belirlenmiştir (böyle bir başka hidroliz ürünü AtOOH'dur).[49] İyi karakterize edilmiş AtO–3 anyonu, örneğin, bir potasyum hidroksit çözeltisi içinde astatinin potasyum hipoklorit ile oksidasyonu ile elde edilebilir. Astatinin sıcak bir Na2S2O8 çözeltisi ile oksidasyonunu takiben lantan triastatat La(AtO3)3'ün hazırlanması rapor edilmiştir.[17] Ksenon diflorür (sıcak bir alkalin çözeltisi içinde) veya periyodat (nötr veya bir alkalin çözeltisi içinde) gibi AtO–3'ün daha fazla oksidasyonu, perastatat iyonu AtO–4'ü verir; bu sadece nötr veya alkalin çözeltilerde kararlıdır. Astatinin ayrıca, iyodat veya dikromat gibi oksiyanyonlu tuzlarda katyonlar oluşturabildiği düşünülmektedir; bu, asidik çözeltilerde, tek değerlikli veya ara pozitif astatin gümüş(I) iyodat veya talyum(I) dikromat gibi metal katyonlarının çözünmeyen tuzları ile birlikte çökeltildiği gözlemine dayanır.
Astatin diğer kalkojenlere bağlar oluşturabilir; bunlar arasında kükürt ile S7At+ ve At(CSN)–2, selenyum ile bir koordinasyon selenourea bileşiği ve tellür ile bir astatin-tellür kolloid bulunur.
Astatinin buhar halindeki daha hafif homologları iyot, brom ve klor ile reaksiyona girdiği bilinmektedir; bu reaksiyonlar AtI, AtBr ve AtCl formüllerine sahip diyatomik interhalojen bileşikleri üretir. İlk iki bileşik suda da üretilebilir – astatin AtI oluşturmak için iyot/iyodür çözeltisi ile reaksiyona girerken, AtBr (astatinden başka) bir iyot/iyot monobromür/bromür çözeltisi gerektirir. Fazla iyodür veya bromür, AtBr–2 ve AtI–2 iyonlarına yol açabilir veya bir klorür çözeltisinde, klorürlerle denge reaksiyonları yoluyla AtCl–2 veya AtBrCl– gibi türler üretebilir. Elementin dikromatla (nitrik asit çözeltisinde) oksidasyonu, klorür ilave edilmesinin astatini AtCl veya AtOCl olması muhtemel bir moleküle dönüştürdüğünü gösterdi. Benzer şekilde, AtOCI2–2 veya AtCl–2 üretilebilir. PdAtI2, CsAtI2, TlAtI2 ve PbAtI polihalidlerinin çökeltildiği bilinmekte veya olduğu varsayılmaktadır.[50] Bir plazma iyonu kaynak kütle spektrometresinde, [AtI]+, [AtBr]+ ve [AtCl]+ iyonları, astatin içeren helyum dolu bir hücreye daha hafif halojen buharları sokularak, plazma iyonu halinde kararlı nötr moleküllerin varlığını destekleyerek oluşturulmuştur. Henüz hiçbir astatin florür bulunamamıştır. Bunların yokluğu, başlangıçta oluşturulmuş bir florürün uçucu olmayan bir ürün oluşturmak için cam kabın duvarları ile reaksiyonu da dahil olmak üzere bu tür bileşiklerin aşırı reaktivitesine spekülatif olarak atfedilmiştir. Bu nedenle, bir astatin florür sentezinin mümkün olduğu düşünülmesine rağmen, radon florürün karakterizasyonu için halihazırda kullanıldığı gibi bir sıvı halojen florür çözücüsü gerektirebilir.
Tarih
1869'da Dmitri Mendeleev periyodik tablosunu yayınladığında iyot altındaki alan boştu; Niels Bohr kimyasal elementlerin sınıflandırılmasının fiziksel temelini oluşturduktan sonra, beşinci halojenin oraya ait olduğu önerildi. Resmen tanınan keşfinden önce, "eka-iyot" (Sanskrit eka'dan - "bir"), iyot altında bir boşluk olduğunu (eka-silisyum, eka-bor ve diğerleri gibi) ima etmek için adlandırıldı.[51] Bilim adamları doğada bulmaya çalıştılar; aşırı nadir olduğu düşünüldüğünde, bu girişimler çeşitli yanlış keşiflerle sonuçlanmıştır.
İlk eka-iyot keşfi 1931 yılında Fred Allison ve onun arkadaşları Alabama Politeknik Enstitüsü'nde (şimdi Auburn Üniversitesi) yapıldı. Keşifçiler element 85'e "alabamin" adını ve Ab sembolünü verdiler, bu isim birkaç yıl boyunca kullanıldı.[52][53][54] 1934 yılında, Berkeley'deki Kaliforniya Üniversitesi'nden H. G. MacPherson, Allison'ın yöntemini ve keşfinin geçerliliğini reddetti.[55] 1937'de kimyager Rajendralal De. tarafından başka bir iddia daha vardı. İngiliz Hindistanı'nda (şimdi Bangladeş'te Dhaka) Dacca'da çalışarak, radyum serisinde radyum F (polonyum-210) toryum serisi eşdeğeri olarak izole edildiğini iddia ettiği 85. element için "dakin" adını seçti. Dakin için rapor ettiği özellikler astatine ait değildir; ayrıca, toryum serisinde astatin bulunmaz ve dakin'in gerçek kimliği bilinmemektedir.[56]
1936'da Horia Hulubei ve Yvette Cauchois'nin, ekibi X ışını analizi yoluyla element 85'i keşfettiklerini iddia ettiler. 1939'da, önceki verileri destekleyen ve genişleten başka bir makale yayınladılar. 1944 yılında Hulubei, diğer araştırmacıların çalışmaları tarafından desteklendiğini iddia ederek o zamana kadar elde ettiği verilerin bir özetini yayınladı. II. Dünya Savaşı beş yıl önce başladığı için, muhtemelen [barış için] Romen'den "dor" adını seçti. Hulubei'nin "ine" sonekini barındırmayan bir dil olan Fransızca yazdığı için, kabul edilmiş olsaydı, dor İngilizce olarak "dorine" olarak işlenmiş olurdu. 1947'de Hulubei'nin iddiası, daha sonra yeni unsurların tanınmasından sorumlu IUPAC komitesine başkanlık edecek olan Avusturyalı kimyager Friedrich Paneth tarafından etkili bir şekilde reddedildi. Hulubei'nin örnekleri astatin içermesine rağmen, bunu tespit etme yöntemleri, mevcut tanımlara göre, doğru tanımlamayı sağlamak için çok zayıftı.[57] Ayrıca, element 87'nin (fransiyum) keşfi hakkında daha önce yanlış bir iddiada yer almıştı ve bunun diğer araştırmacıların çalışmalarını önemsizleştirmesine neden olduğu düşünülmektedir.[58]

1940 yılında İsviçreli kimyager Walter Minder, element 85'in, "helvetium" adını (İsviçre'nin Latince adı olan Helvetia'dan) seçerek, radyum A'nın (polonyum-218) beta bozunma ürünü olduğunu keşfettiğini açıkladı. Karlik ve Bernert deneylerini yeniden üretmede başarısız oldular ve daha sonra Minder'in sonuçlarını radon akımının kirlenmesine bağladılar (radon-222, polonyum-218'in ana izotopudur).[59] 1942'de Minder, İngiliz bilim adamı Alice Leigh-Smith ile işbirliği içinde, toryum A (polonyum-216) beta bozunumunun ürünü olduğu varsayılan element 85'in başka bir izotopunun keşfedildiğini duyurdu. Bu maddeye "anglo-helvetium" adını verdiler,[60] ancak Karlik ve Bernert yine bu sonuçları üretemedi.[44]
Daha sonra 1940'ta Dale R. Corson, Kenneth Ross MacKenzie ve Emilio Segrè bu elementi Berkeley'deki California Üniversitesi'nde izole etti. Bilim adamları, doğada elementi aramak yerine, iki nötronun astatin-211 yayılmasından sonra üretmek için bir siklotrondaki (partikül hızlandırıcı) alfa parçacıklarıyla bizmut-209'u bombalayarak yarattılar. Bununla birlikte, keşfediciler hemen bu element için bir ad önermediler. Bunun nedeni, o zamanlar, doğada henüz keşfedilmemiş olan "görünmez miktarlarda" sentetik olarak yaratılmış bir elementin tamamen geçerli bir unsur olarak görülmemesiydi; ayrıca, kimyagerler radyoaktif izotopları meşru olarak stabil olanlar olarak tanımak konusunda isteksizdi.[61] 1943'te astatin, Berta Karlik ve Traude Bernert tarafından önce uranyum serisinde, sonra aktinyum serisinde doğal olarak oluşan iki bozunma zincirinin bir ürünü olarak bulundu.[62][63] (O zamandan beri, üçüncü bir bozunma zincirinde, neptünyum serisinde de astatin bulundu.[64]) 1946'da Friedrich Paneth, nihayetinde sentetik elementleri tanımaya çağırdı, diğer nedenlerin yanı sıra, doğal oluşumlarının yakın zamanda teyit edildiğini ve yeni keşfedilen isimsiz elementlerin keşfedicilerinin bu elementleri adlandırmasını önerdi. 1947'nin başlarında, Doğa keşfedicilerin önerilerini yayınladı; Corson, MacKenzie ve Segrè'den bir mektup, radyoaktif bozunma eğilimi nedeniyle, Yunan astatos (αστατος) "kararsız" anlamına gelen "astatin"[61] adını önerdi. İsim, aynı zamanda, ismin o elementin bir özelliğine atıfta bulunduğu dört kararlı halojenin geleneğini sürdürmek için seçildi.[65]
Corson ve meslektaşları analitik kimyası temelinde astatini metal olarak sınıflandırdılar. Müteakip araştırmacılar iyot benzeri,[66][67] katyonik[68][69] veya amfoterik davranış bildirdiler.[70][71] 2003 retrospektifinde Corson, "[astatinin] bazı özelliklerinin iyodine benzediğini… daha çok metalik komşuları Po ve Bi gibi metalik özellikler sergilediğini” yazdı.[65]
İzotoplar
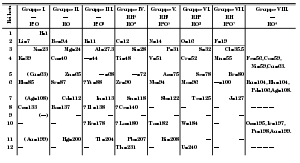
| Örnek astatin izotopları için alfa bozunma özellikleri | ||||||
|---|---|---|---|---|---|---|
| Kütle numarası |
Kütle fazlalığı[2] |
Yarı ömür[2] | Alfa bozunma olasılığı[2] |
Alfa bozunma yarı ömürü | ||
| 207 | -13.243 MeV | 1.80 h | 8,6% | 20.9 h | ||
| 208 | -12.491 MeV | 1.63 h | 0,55% | 12.3 g | ||
| 209 | -12.880 MeV | 5.41 h | 4,1% | 5.5 g | ||
| 210 | -11.972 MeV | 8.1 h | 0,175% | 193 g | ||
| 211 | -11.647 MeV | 7.21 h | 41,8% | 17.2 h | ||
| 212 | -8.621 MeV | 0.31 s | ≈100% | 0.31 s | ||
| 213 | -6.579 MeV | 125 ns | 100% | 125 ns | ||
| 214 | -3.380 MeV | 558 ns | 100% | 558 ns | ||
| 219 | 10.397 MeV | 56 s | 97% | 58 s | ||
| 220 | 14.350 MeV | 3.71 dk | 8% | 46.4 dk | ||
| 221 | 16.810 MeV | 2.3 dk | deneysel olarak alfa kararlı |
∞ | ||
191-229 atomik kütleleri olan 39 tane bilinen astatin izotopu vardır. Teorik modelleme, 37 tane daha izotopun var olabileceğini düşündürmektedir.[72] Kararlı veya uzun ömürlü bir astatin izotopuna rastlanmamıştır ve bunun olması beklenmemektedir.
Astatin'in alfa bozunma enerjileri diğer ağır elementlerle aynı eğilimi izler. Daha hafif astatin izotopları, çekirdekler ağırlaştıkça daha düşük hale gelen oldukça yüksek alfa bozunma enerjilerine sahiptir. Astatin-211, önceki izotoptan önemli ölçüde daha yüksek bir enerjiye sahiptir, çünkü 126 nötronlu bir çekirdeğe sahiptir ve 126, doldurulmuş bir nötron kabuğuna karşılık gelen sihir sayısıdır. Önceki izotop ile benzer bir yarı ömre sahip olmasına rağmen (astatin-210 için 8.1 saat ve astatin-211 için 7.2 saat), alfa ayrışma olasılığı ikincisi için çok daha yüksektir: sadece %0.18'e karşı %41.81.[2] Aşağıdaki iki izotop daha fazla enerji salar, astatin-213 en fazla enerjiyi serbest bırakır. Bu nedenle en kısa ömürlü astatin izotopudur. Ağır astatin izotopları daha az enerji salarsa da, beta bozunmasının (elektron emisyonu) artan rolü nedeniyle uzun ömürlü bir astatin izotopu mevcut değildir. Bu ayrışma modu özellikle astatin için önemlidir; 1950 gibi erken bir tarihte, elementin tüm izotoplarının beta bozunmasına uğradığı,[73] ancak nükleer kütle ölçümlerinin A = 215 olan tüm izobarların en düşük kütlesine sahip olduğu için 215At'ın aslında beta-stabil olduğunu ortaya koyduğu varsayılmıştır.[2] Astatin-213, astatin-214 ve astatin-216m hariç diğer tüm astatin izotopları için bir beta bozunma modu bulunmuştur.[2] Astatin-210 ve daha hafif izotoplarda beta artı bozunma (pozitron emisyonu), astatin-216 ve daha ağır izotoplarda beta (eksi) bozunma görülür ve astatin-212 her iki modda bozunurken, astatin-211 elektron yakalanması işleminden geçer.[2]
En kararlı izotop, yarı ömürü 8.1 saat olan astatin-210'dur. Birincil bozunma modu, beta artı, nispeten uzun ömürlü (astatin izotoplarına kıyasla) alfa yayıcı polonyum-210'a göre. Toplamda, sadece beş izotopun yarı ömrü bir saati aşmaktadır (astatin-207 ila -211). En az kararlı zemin durumu izotopu, 125 nanosaniye yarı ömüre sahip astatin-213'tür. Son derece uzun ömürlü bizmut-209'a alfa bozunmasına uğrar.[2]
Astatin, bilinen bir durumda bir veya daha fazla nükleon (proton veya nötron) çekirdeği olan bilinen 24 nükleer izomere sahiptir. Bir nükleer izomer "meta-durum" olarak da adlandırılabilir, yani sistem "zemin durumundan" (mümkün olan en düşük dahili enerjiye sahip durum) daha fazla iç enerjiye sahiptir, bu da birincisinin ikincisine bozunmasını sağlar. Her izotop için birden fazla izomer olabilir. Bu nükleer izomerlerden en kararlı olanı, yaklaşık 3 dakikalık bir yarı ömüre sahip olan, tüm yer durumlarının 203-211 ve 220 izotoplarından daha uzun olan astatin-202m1'dir. En az kararlı olan astatin-214ml'dir; 265 nanosaniyelik yarı ömür, astatin-213 dışındaki tüm zemin durumlarından daha kısadır.[2][72]
Doğal oluşum
.svg.png.webp)
Astatin en nadir bulunan doğal elementtir. Dünya kabuğundaki toplam astatin miktarının (belirtilen kütle 2.36 × 1025 gram),[74] herhangi bir zamanda bir gramdan daha az olduğu tahmin edilmektedir.[4] Diğer kaynaklar, herhangi bir anda yeryüzünde bulunan geçici astatin miktarının bir ons'a kadar olduğunu tahmin ediyor.[75]
Dünya'nın oluşumunda mevcut olan herhangi bir astatin çoktan kayboldu; doğal olarak oluşan dört izotop (astatin-215, -217, -218 ve -219), radyoaktif toryum ve uranyum cevherlerinin bozunması ve eser miktarda neptünyum-237'nin bir sonucu olarak sürekli olarak üretilir. Kuzey ve Güney Amerika'nın kara kütleleri, 16 kilometrelik (10 mil) derinlikte birleştiğinde, herhangi bir zamanda sadece yaklaşık bir trilyon astatin-215 atomu içerir (yaklaşık 3.5 × 10−10 gram).[76] Astatin-217, neptunyum-237'nin radyoaktif bozunması ile üretilir. İkinci izotopun primordial kalıntıları 2.14 milyon yıllık nispeten kısa yarı ömürü nedeniyle artık Dünya'da mevcut değildir. Ancak, eser miktarlar doğal olarak uranyum cevherlerindeki dönüşüm reaksiyonlarının bir ürünü olarak ortaya çıkar.[77] Astatin-218, doğada bulunan ilk astatin izotopudur. 56 saniyelik yarılanma ömrüne sahip olan astatin-219, doğal olarak oluşan izotopların en uzun ömürlü olanıdır.[2]
Astatinin izotopları, literatürde böyle bir izotop veya tutarsızlık bulunmadığına dair yanlış düşünmeler[70] nedeniyle bazen doğal olarak ortaya çıkan maddeler olarak listelenmezler. Astatin-216 doğal olarak oluşan bir izotop olarak sayılmıştır, ancak gözleminin (şüpheli olarak tanımlanmıştır) raporları doğrulanmamıştır.
Sentezi
Oluşum
| Reaksiyon | Alfa parçacığı enerjisi |
|---|---|
| 20983Bi + 42He → 21185At + 2 10n | 26 MeV[44] |
| 20983Bi + 42He → 21085At + 3 10n | 40 MeV[44] |
| 20983Bi + 42He → 20985At + 4 10n | 60 MeV |
Astatin ilk olarak bizmut-209'u enerjik alfa parçacıkları ile bombalayarak üretildi ve bu hala nispeten uzun ömürlü izotopları astatin-209'dan astatin-211'e oluşturmak için kullanılan ana yoldur. Astatin sadece ufak miktarlarda üretilir, modern teknikler 6.6 giga cebe kadar (yaklaşık 86 nanogram veya 2.47 × 1014 atom) üretime izin verir.[78] Bu yöntemi kullanarak daha büyük miktarlarda astatin sentezi, uygun siklotronların sınırlı mevcudiyeti ve hedefi erime olasılığı ile sınırlıdır. Astatin bozunmasının[79] kümülatif etkisine bağlı çözücü radyolizi, ilgili bir sorundur. Kriyojenik teknoloji ile, mikrogram miktarlarında astatin, radon-211'i vermek üzere toryum veya uranyumun proton ışınlaması ile üretilebilir ve daha sonra astatin-211'e bozunur. Astatin-210 ile kontaminasyonun bu yöntemin bir dezavantajı olması beklenmektedir.[80]
Astatin-211 ticari kullanımdaki en önemli tek izotoptur. Bizmut hedefini üretmek için metal, santimetre kare başına 50 ila 100 miligramda bir altın, bakır veya alüminyum yüzeye püskürtülür. Bunun yerine bizmut oksit kullanılabilir; bu zorla bakır bir plaka ile kaynaştırılır. Hedef kimyasal olarak nötr bir azot atmosferi[81] altında tutulur ve erken astatin buharlaşmasını önlemek için su ile soğutulur. Bir siklotron gibi bir parçacık hızlandırıcıda,[82] alfa parçacıkları bizmutla çarpışır. Sadece bir bizmut izotopu kullanılmasına rağmen (bizmut-209), reaksiyon astatin-209, astatin-210 veya astatin-211 üreten üç olası şekilde meydana gelebilir. İstenmeyen nüklidleri ortadan kaldırmak için, partikül hızlandırıcısının maksimum enerjisi, astatin-211 üreten reaksiyon için (istenen izotop üretmek için) ve astatin-210 üreten (aşağıda olmak üzere) değerin (optimal olarak 29.17 MeV)[83] değerine ayarlanır. diğer astatin izotopları üretmekten kaçının).
Ayırma yöntemleri
Astatin sentezin ana ürünü olduğundan, oluşumundan sonra sadece hedeften ve önemli kirleticilerden ayrılmalıdır. Birkaç yöntem mevcuttur, "ancak bunlar genel olarak iki yaklaşımdan birini izler—hedefin kuru damıtma veya [ıslak] asit işlemi ve ardından çözücü ekstraksiyonu." Aşağıda özetlenen yöntemler, Kugler ve Keller tarafından gözden geçirildiği gibi eski prosedürlerin modern uyarlamalarıdır. 1985 öncesi teknikler genellikle birlikte üretilen toksik polonyumun ortadan kaldırılmasına yönelikti; bu gereklilik şimdi siklotron ışınım demetinin enerjisinin sınırlanmasıyla azaltılmaktadır.
Kuru
Astatin içeren siklotron hedefi yaklaşık 650 °C'lik bir sıcaklığa ısıtılır. Astatin buharlaşır ve (tipik olarak) bir soğuk tuzakta yoğunlaştırılır. Yaklaşık 850 °C'ye kadar daha yüksek sıcaklıklar, eşzamanlı buharlaşma nedeniyle bizmut kontaminasyonu riski altında verimi artırabilir. Bizmut varlığını en aza indirmek için kondensatın yeniden ısıtılması gerekebilir (bizmut astatin etiketleme reaksiyonlarına müdahale edebilir). Astatin, sodyum hidroksit, metanol veya kloroform gibi bir veya daha fazla düşük konsantrasyonlu çözücü kullanılarak tuzaktan geri kazanılır. Yaklaşık %80'e kadar astatin verimi elde edilebilir. Kuru ayırma, kimyasal olarak faydalı bir astatin formunu üretmek için en yaygın olarak kullanılan yöntemdir.[78][84]
Islak
Işınlanmış bizmut (veya bazen bizmut trioksit) hedefi ilk olarak örneğin konsantre nitrik veya perklorik asit içinde çözülür. Bu ilk adımı takiben asit, hem bizmut hem de arzu edilen astatin ürününü içeren beyaz bir tortu geride bırakılmak üzere damıtılabilir. Bu tortu daha sonra hidroklorik asit gibi konsantre bir asit içerisinde çözündürülür. Astatin, butil veya izopropil eter, diizopropileter (DIPE) veya tiyosemikarbazid gibi organik bir çözücü kullanılarak bu asitten çıkarılır. Sıvı-sıvı ekstraksiyonu kullanılarak, astatin ürünü tekrar tekrar HCI gibi bir asitle yıkanabilir ve organik çözücü tabakasına ekstrakte edilebilir. Saflaştırma prosedürleri tamamlandığında %72'ye düşen nitrik asit kullanarak %93'lük bir ayırma verimi bildirilmiştir (nitrik asidin damıtılması, kalıntı azot oksitlerin temizlenmesi ve sıvı-sıvı ekstraksiyonunu[85][86] sağlamak için bizmut nitratın yeniden çözülmesi). Islak yöntemler, "çoklu radyoaktivite idare aşamaları"nı içerir ve daha büyük miktarlarda astatinin izole edilmesi için uygun görülmemiştir. Ancak, ıslak ekstraksiyon yöntemleri, daha büyük miktarlarda astatin-211 üretiminde kullanılmak üzere incelenmektedir, çünkü ıslak ekstraksiyon yöntemlerinin daha fazla tutarlılık sağlayabileceği düşünülmektedir.[86] Belirli bir oksidasyon durumunda astatin üretimini sağlayabilirler ve deneysel radyokimyada daha fazla uygulanabilirliğe sahip olabilirler.
Kullanımlar ve önlemler
Birkaç 211At-içeren moleküller ve deneysel kullanımları Etken Uygulamalar [211At]astatin-tellür kolloidler Bölmeli tümörler 6-[211At]astato-2-metil-1,4-naftakuinol difosfat Adenokarsinomlar 211At-etiketli metilen mavisi Melanomlar Meta-[211At]astatobenzil guanidin Nöroendokrin tümörler 5-[211At]astato-2'-deoksiuridin Çeşitli 211At-etiketli biyotin konjugatları Çeşitli ön hedefleme 211At-etiketli oktreotid Somatostatin reseptörü 211At-etiketli monoklonal antikorlar ve parçalar Çeşitli 211At-etiketli bisfosfonatlar Kemik metastazı
Yeni oluşan astatin-211, nükleer tıpta devam eden araştırmaların konusudur. 7,2 saatlik yarı ömürü ile bozunması nedeniyle hızlı kullanılmalıdır; bu çok aşamalı etiketleme stratejilerine izin verecek kadar uzundur. Astatin-211, bir alfa parçacığının emisyonu (bizmut-207'ye)[87] veya elektron yakalama (son derece kısa ömürlü bir nüklite, polonyum-211'e) bozunması nedeniyle hedeflenmiş alfa-parçacık tedavisi için potansiyele sahiptir. çürüme), çok hızlı bir şekilde istikrarlı torunu kurşun-207 ulaşır. 77-92 keV aralığında elektron yakalama dalının bir sonucu olarak yayılan Polonyum X-ışınları, hayvanlarda ve hastalarda astatinin izlenmesini sağlar. Astatin-210'un biraz daha uzun bir yarı ömrü olmasına rağmen, tamamen uygun değildir çünkü genellikle son derece toksik polonyum-210'a beta artı bozunma geçirir.[88]
Astatin-211 ve iyot-131 (tıpta da kullanılan bir radyoaktif iyot izotopu) arasındaki temel tıbbi fark, iyot-131'in yüksek enerjili beta parçacıkları yaymasıdır ve astatin yapmaz. Beta parçacıkları dokulardan çok daha ağır alfa parçacıklarına göre çok daha fazla nüfuz etme gücüne sahiptir. Astatin-211 tarafından salınan ortalama bir alfa parçacığı, çevre dokular boyunca 70 µm'ye kadar ilerleyebilir; iyot-131 tarafından yayılan ortalama enerjili bir beta partikülü yaklaşık 30 kat daha fazla, yaklaşık 2 mm'ye kadar seyahat edebilir. Alfa radyasyonunun dokulardan kısa yarılanma ömrü ve sınırlı nüfuz etme gücü, "tümör yükünün düşük olduğu ve / veya habis hücre popülasyonlarının temel normal dokuların yakınında yer aldığı" durumlarda avantajlar sağlar. İnsan kanserlerinin hücre kültürü modellerinde önemli bir morbidite, hücre başına bağlı bir ila on astatin-211 atomu ile elde edilmiştir.
P Durbin, Human Radiation Studies: Remembering the Early Years, 1995
Kanser tedavisi için astatin bazlı radyofarmasötiklerin geliştirilmesinde bazı engellerle karşılaşılmıştır. II. Dünya Savaşı araştırmayı on yıla yakın bir süre erteledi. İlk deneylerin sonuçları, kanser seçici bir taşıyıcının geliştirilmesi gerektiğini gösterdi ve 1970'lere kadar bu amaç için monoklonal antikorlar mevcut değildi. İyotun aksine, astatin, bu tür moleküler taşıyıcılardan, özellikle sp3 karbon bölgelerinde (sp2 bölgelerinden daha az) dehalojenat eğilimi gösterir. Vücutta biriken ve tutulan astatinin toksisitesi göz önüne alındığında, bu onun konak molekülüne bağlı kalmasını sağlama ihtiyacını vurguladı. Yavaşça metabolize olan astatin taşıyıcıları etkinlikleri açısından değerlendirilebilirken, daha hızlı metabolize olan taşıyıcılar nükleer tıpta astatinin değerlendirilmesinde önemli bir engel olmaya devam etmektedir. Etiketleme kimyasının ve taşıyıcı moleküllerin astatine bağlı radyolojisinin etkilerinin hafifletilmesi, daha fazla gelişme gerektiren başka bir alandır. Bir kanser tedavisi olarak astatin için pratik bir uygulama, potansiyel olarak "şaşırtıcı" sayıda hasta için uygun olacaktır; ihtiyaç duyulacak miktarlarda astatin üretimi bir sorun olmaya devam etmektedir.[80][90]
Hayvan çalışmaları, astatinin, iyota benzer şekilde – daha az ölçüde de olsa, belki de biraz daha metalik yapısı[75] nedeniyle - tiroit bezinde tercihen (ve tehlikeli bir şekilde) yoğunlaştığını göstermektedir. İyotun aksine, astatin muhtemelen At– ila At+ 'nın vücut içi oksidasyonu nedeniyle akciğerler ve dalak tarafından alınma eğilimi gösterir.[37] Bir radyokolloid şeklinde uygulanırsa, karaciğerde konsantre olma eğilimindedir. Sıçanlarda ve maymunlarda yapılan deneyler, astatin-211'in tiroit bezine iyot-131'e göre çok daha fazla zarar verdiğini, tekrarlayan nüklid enjeksiyonu ile bezde nekroz ve hücre displazisine neden olduğunu göstermektedir. Erken araştırmalar, dişi kemirgenlerine astatin enjeksiyonunun göğüs dokusunda morfolojik değişikliklere neden olduğunu;[91] bu sonuç yıllarca tartışmalıdır.[89] Daha sonra bunun muhtemelen göğüs dokusunun ışınlanmasının yumurtalıkların ışınlanmasına bağlı hormonal değişikliklerle birlikte neden olduğu sonucuna varıldı. İyi havalandırıldıklarında eser miktarda astatin çeker ocaklarda güvenle kullanılabilir; elementin biyolojik alımından kaçınılmalıdır.[92]
Ayrıca bakınız
Kaynakça
- Bonchev, Danail; Kamenska, Verginia (1981). "Predicting the properties of the 113–120 transactinide elements". The Journal of Physical Chemistry. 85 (9). ACS Publications. ss. 1177-86. doi:10.1021/j150609a021. Erişim tarihi: 6 Mayıs 2013.
- Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik(2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- Greenwood, N. N.; Earnshaw, A. (2002). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Wiberg, N., ed. (2001). Holleman-Wiberg: Inorganic Chemistry. Translation of 101st German edition by M. Eagleson and W. D. Brewer, English language editor B. J. Aylett. Academic Press. p. 423. ISBN 978-0-12-352651-9.
- Emsley, J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). Oxford University Press. pp. 57–58. ISBN 978-0-19-960563-7.
- Hermann, A.; Hoffmann, R.; Ashcroft, N. W. (2013). "Condensed Astatine: Monatomic and Metallic". Physical Review Letters. 111 (11): 116404-1–116404-5. Bibcode:2013PhRvL.111k6404H. doi:10.1103/PhysRevLett.111.116404. PMID 24074111.
- Kotz, J. C.; Treichel, P. M.; Townsend, J. (2011). Chemistry & Chemical Reactivity (8th ed.). Cengage Learning. p. 65. ISBN 978-0-8400-4828-8.
- Jahn, T. P. (2010). MIPS and Their Role in the Exchange of Metalloids. 679. Springer. p. 41. ISBN 978-1-4419-6314-7.
- Siekierski, S.; Burgess, J. (2002). Concise Chemistry of the Elements. Horwood. pp. 65, 122. ISBN 978-1-898563-71-6.
- Maddock, A. G. (1956). "Astatine". Supplement to Mellor's Comprehensive Treatise on Inorganic and Theoretical Chemistry, Supplement II, Part 1, (F, Cl, Br, I, At). Longmans, Green & Co. (Ltd.). pp. 1064–1079.
- Garrett, A. B.; Richardson, J. B.; Kiefer, A. S. (1961). Chemistry: A First Course in Modern Chemistry. Ginn. p. 313.
- Seaborg, G. T. (2015). "Transuranium element". Encyclopædia Britannica. Retrieved 24 February 2015.
- Oon, H. L. (2007). Chemistry Expression: An Inquiry Approach. John Wiley and Sons. p. 300. ISBN 978-981-271-162-5.
- Hansen, P. F. (2009). Jensen, O. M. (ed.). The Science of Construction Materials. Springer. p. B.2. ISBN 978-3-540-70897-1.
- Otozai, K.; Takahashi, N. (1982). "Estimation Chemical Form Boiling Point Elementary Astatine by Radio Gas Chromatography" 20 Aralık 2013 tarihinde Wayback Machine sitesinde arşivlendi.. Radiochimica Acta. 31 (3–4): 201–203. doi:10.1524/ract.1982.31.34.201.
- McLaughlin, R. (1964). "Absorption Spectrum of Astatine" 25 Ağustos 2019 tarihinde Wayback Machine sitesinde arşivlendi.. Journal of the Optical Society of America. 54 (8): 965–967. Bibcode:1964JOSA...54..965M. doi:10.1364/JOSA.54.000965.
- Lavrukhina, Avgusta Konstantinovna; Pozdnyakov, Aleksandr Aleksandrovich (1970). Analytical Chemistry of Technetium, Promethium, Astatine, and Francium. Translated by R. Kondor. Ann Arbor–Humphrey Science Publishers. ISBN 978-0-250-39923-9.
- Donohue, J. (1982). The Structures of the Elements. Robert E. Krieger. p. 400. ISBN 978-0-89874-230-5.
- Vernon, R. (2013). "Which Elements are Metalloids?". Journal of Chemical Education. 90 (12): 1703–1707 (1704). Bibcode:2013JChEd..90.1703V. doi:10.1021/ed3008457.
- Merinis, J.; Legoux, G.; Bouissières, G. (1972). "Etude de la formation en phase gazeuse de composés interhalogénés d'astate par thermochromatographie" [Study of the gas-phase formation of interhalogen compounds of astatine by thermochromatography]. Radiochemical and Radioanalytical Letters (in French). 11 (1): 59–64.
- Takahashi, N.; Otozai, K. (1986). "The Mechanism of the Reaction of Elementary Astatine with Organic Solvents". Journal of Radioanalytical and Nuclear Chemistry. 103: 1–9. doi:10.1007/BF02165358.
- Takahashi, N.; Yano, D.; Baba, H. (1992). "Chemical Behavior of Astatine Molecules". Proceedings of the International Conference on Evolution in Beam Applications, Takasaki, Japan, 5–8 November 1991. pp. 536–539.
- Zuckerman, J. J.; Hagen, A. P. (1989). Inorganic Reactions and Methods, Volume 3, The Formation of Bonds to Halogens (Part 1). John Wiley & Sons. ISBN 978-0-471-18656-4.
- Kugler, H. K.; Keller, C. (1985). 'At, Astatine', System No. 8a. Gmelin Handbook of Inorganic and Organometallic Chemistry. 8 (8. bas.). Springer-Verlag. ISBN 978-3-540-93516-2.
- Meyers, R. A. (2001). "Halogen Chemistry". Encyclopedia of Physical Science and Technology (3rd ed.). Academic Press. pp. 197–222 (202). ISBN 978-0-12-227410-7.
- Keller, C.; Wolf, W.; Shani, J. (2011). "Radionuclides, 2. Radioactive Elements and Artificial Radionuclides". Ullmann's Encyclopedia of Industrial Chemistry. 31. pp. 89–117 (96). doi:10.1002/14356007.o22_o15. ISBN 978-3-527-30673-2.
- Zumdahl, S. S.; Zumdahl, S. A. (2008). Chemistry (8th ed.). Cengage Learning. p. 56. ISBN 978-0-547-12532-9.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic chemistry (3rd ed.). Pearson Education. p. 533. ISBN 978-0-13-175553-6.
- Visscher, L.; Dyall, K. G. (1996). "Relativistic and Correlation Effects on Molecular properties. I. The Dihalogens F2, Cl2, Br2, I2, and At2". The Journal of Chemical Physics. 104 (22): 9040–9046. Bibcode:1996JChPh.104.9040V. doi:10.1063/1.471636.
- Glushko, V. P.; Medvedev, V. A.; Bergma, G. A. (1966). Termicheskie Konstanty Veshchestv (in Russian). 1. Nakua. p. 65.
- Rao, C. N. R.; Ganguly, P. (1986). "A New Criterion for the Metallicity of Elements". Solid State Communications. 57 (1): 5–6. Bibcode:1986SSCom..57....5R. doi:10.1016/0038-1098(86)90659-9.
- Kaye, G. W. C.; Laby, T. H. (1973). Tables of Physical and Chemical Constants (14 ed.). Longman. ISBN 978-0-582-46326-4.
- Smith, A.; Ehret, W. F. (1960). College chemistry. Appleton-Century-Crofts. p. 457.
- Champion, J.; Seydou, M.; Sabatié-Gogova, A.; Renault, E.; Montavon, G.; Galland, N. (2011). "Assessment of an Effective Quasirelativistic Methodology Designed to Study Astatine Chemistry in Aqueous Solution" (PDF). Physical Chemistry Chemical Physics. 13 (33): 14984–14992 (14984). Bibcode:2011PCCP...1314984C. doi:10.1039/C1CP20512A. PMID 21769335.
- Champion, J.; Alliot, C.; Renault, E.; Mokili, B. M.; Chérel, M.; Galland, N.; Montavon, G. (2010). "Astatine Standard Redox Potentials and Speciation in Acidic Medium" 22 Şubat 2017 tarihinde Wayback Machine sitesinde arşivlendi.. The Journal of Physical Chemistry A. 114 (1): 576–582 (581). Bibcode:2010JPCA..114..576C. doi:10.1021/jp9077008. PMID 20014840.
- Milesz, S.; Jovchev, M.; Schumann, D.; Khalkin, V. A. (1988). "The EDTA Complexes of Astatine". Journal of Radioanalytical and Nuclear Chemistry. 127 (3): 193–198. doi:10.1007/BF02164864.
- Guérard, F.; Gestin, J.-F.; Brechbiel, M. W. (2013). "Production of [211At]-Astatinated Radiopharmaceuticals and Applications in Targeted α-Particle Therapy". Cancer Biotherapy and Radiopharmaceuticals. 28 (1): 1–20. doi:10.1089/cbr.2012.1292. PMC 3545490. PMID 23075373.
- Dolg, M.; Kuchle, W.; Stoll, H.; Preuss, H.; Schwerdtfeger, P. (1991). "Ab Initio Pseudopotentials for Hg to Rn: II. Molecular Calculations on the Hydrides of Hg to At and the Fluorides of Rn". Molecular Physics. 74 (6): 1265–1285 (1265, 1270, 1282). Bibcode:1991MolPh..74.1265D. doi:10.1080/00268979100102951.
- Saue, T.; Faegri, K.; Gropen, O. (1996). "Relativistic Effects on the Bonding of Heavy and Superheavy Hydrogen Halides". Chemical Physics Letters. 263 (3–4): 360–366 (361–362). Bibcode:1996CPL...263..360S. doi:10.1016/S0009-2614(96)01250-X.
- Barysz, M. (2010). Relativistic Methods for Chemists 3 Haziran 2016 tarihinde Wayback Machine sitesinde arşivlendi.. Springer. p. 79. ISBN 978-1-4020-9974-8.
- Thayer, J. S. (2005). "Relativistic Effects and the Chemistry of the Heaviest Main-group elements". Journal of Chemical Education. 82 (11): 1721–1727 (1725). Bibcode:2005JChEd..82.1721T. doi:10.1021/ed082p1721.
- Wulfsberg, G. (2000). Inorganic Chemistry. University Science Books. p. 37. ISBN 978-1-891389-01-6.
- Anders, E. (1959). "Technetium and astatine chemistry". Annual Review of Nuclear Science. 9: 203–220. Bibcode:1959ARNPS...9..203A. doi:10.1146/annurev.ns.09.120159.001223.
- Nefedov, V. D.; Norseev, Yu. V.; Toropova, M. A.; Khalkin, Vladimir A. (1968). "Astatine". Russian Chemical Reviews. 37 (2): 87–98. Bibcode:1968RuCRv..37...87N. doi:10.1070/RC1968v037n02ABEH001603.
- Aten, A. H. W., Jr.; Doorgeest, T.; Hollstein, U.; Moeken, H. P. (1952). "Section 5: Radiochemical Methods. Analytical Chemistry of Astatine". Analyst. 77 (920): 774–777. Bibcode:1952Ana....77..774A. doi:10.1039/AN9527700774.
- Davidson, M. (2000). Contemporary boron chemistry 29 Haziran 2016 tarihinde Wayback Machine sitesinde arşivlendi.. Royal Society of Chemistry. p. 146. ISBN 978-0-85404-835-9.
- Elgqvist, J.; Hultborn, R.; Lindegren, S.; Palm, S. (2011). "Ovarian cancer: background and clinical perspectives". In Speer, S. (ed.). Targeted Radionuclide Therapy. Lippincott Williams & Wilkins. pp. 380–396 (383). ISBN 978-0-7817-9693-4.
- Brookhart, M.; Grant, B.; Volpe, A. F. (1992). "[(3,5-(CF3)2C6H3)4B]-[H(OEt2)2]+: a convenient reagent for generation and stabilization of cationic, highly electrophilic organometallic complexes". Organometallics. 11 (11): 3920–3922. doi:10.1021/om00059a071.
- Sergentu, Dumitru-Claudiu; Teze, David; Sabatié-Gogova, Andréa; Alliot, Cyrille; Guo, Ning; Bassel, Fadel; Da Silva, Isidro; Deniaud, David; Maurice, Rémi; Champion, Julie; Galland, Nicolas; Montavon, Gilles (2016). "Advances on the Determination of the Astatine Pourbaix Diagram: Predomination of AtO(OH)2− over At− in Basic Conditions". Chem. Eur. J. 2016 (22): 2964–71. doi:10.1002/chem.201504403. PMID 26773333.
- Brinkman, G. A.; Aten, H. W. (1963). "Decomposition of Caesium Diiodo Astatate (I), (CsAtI2)". Radiochimica Acta. 2 (1): 48. doi:10.1524/ract.1963.2.1.48.
- Ball, P. (2002). The Ingredients: A Guided Tour of the Elements. Oxford University Press. pp. 100–102. ISBN 978-0-19-284100-1.
- Allison, F.; Murphy, E. J.; Bishop, E. R.; Sommer, A. L. (1931). "Evidence of the Detection of Element 85 in Certain Substances". Physical Review. 37 (9): 1178–1180. Bibcode:931Ph1Rv...37.1178A. doi:10.1103/PhysRev.37.1178.
- "Alabamine & Virginium" 30 Ocak 2011 tarihinde Wayback Machine sitesinde arşivlendi.. Time Magazine. 15 February 1932.
- Trimble, R. F. (1975). "What Happened to Alabamine, Virginium, and Illinium?". Journal of Chemical Education. 52 (9): 585. Bibcode:1975JChEd..52..585T. doi:10.1021/ed052p585.
- MacPherson, H. G. (1934). "An Investigation of the Magneto-optic Method of Chemical Analysis". Physical Review. 47 (4): 310–315. Bibcode:1935PhRv...47..310M. doi:10.1103/PhysRev.47.310.
- Mellor, J. W. (1965). A Comprehensive Treatise on Inorganic and Theoretical Chemistry. Longmans, Green. p. 1066. OCLC 13842122.
- Burdette, S. C.; Thornton, B. F. (2010). "Finding Eka-Iodine: Discovery Priority in Modern Times" 30 Aralık 2015 tarihinde Wayback Machine sitesinde arşivlendi. (PDF). Bulletin for the History of Chemistry. 35: 86–96.
- Scerri, E. (2013). A Tale of 7 Elements (Googe Play ed.). Oxford University Press. pp. 188–190, 206. ISBN 978-0-19-539131-2.
- Karlik, B.; Bernert, T. (1942). "Über Eine Vermutete β-Strahlung des Radium A und die Natürliche Existenz des Elementes 85" [About a Suspected β-radiation of Radium A, and the Natural Existence of the Element 85]. Naturwissenschaften (in German). 30 (44–45): 685–686. Bibcode:1942NW.....30..685K. doi:10.1007/BF01487965.
- Leigh-Smith, A.; Minder, W. (1942). "Experimental Evidence of the Existence of Element 85 in the Thorium Family". Nature. 150 (3817): 767–768. Bibcode:1942Natur.150..767L. doi:10.1038/150767a0.
- Davis, Helen Miles (1959). The Chemical Elements 23 Ağustos 2017 tarihinde Wayback Machine sitesinde arşivlendi. (PDF) (2nd ed.). Science Service, Ballantine Books. p. 29.
- Karlik, B.; Bernert, T. (1943). "Eine Neue Natürliche α-Strahlung" [A New Natural α-radiation]. Naturwissenschaften (in German). 31 (25–26): 298–299. Bibcode:1943NW.....31..298K. doi:10.1007/BF01475613.
- Karlik, B.; Bernert, T. (1943). "Das Element 85 in den Natürlichen Zerfallsreihen" [The Element 85 in the Natural Decay Chains]. Zeitschrift für Physik (in German). 123 (1–2): 51–72. Bibcode:1944ZPhy..123...51K. doi:10.1007/BF01375144.
- Lederer, C. M.; Hollander, J. M.; Perlman, I. (1967). Table of Isotopes (6th ed.). John Wiley & Sons. pp. 1–657.
- Corson, D. R. (2003). "Astatine" 28 Eylül 2018 tarihinde Wayback Machine sitesinde arşivlendi.. Chemical & Engineering News. 81 (36): 158. doi:10.1021/cen-v081n036.p158.
- Hamilton, J. G.; Soley, M. H. (1940). "A Comparison of the Metabolism of Iodine and of Element 85 (Eka-Iodine)". Proceedings of the National Academy of Sciences. 26 (8): 483–489. Bibcode:1940PNAS...26..483H. doi:10.1073/pnas.26.8.483. PMC 1078214. PMID 16588388.
- Neumann, H. M. (1957). "Solvent Distribution Studies of the Chemistry of Astatine". Journal of Inorganic and Nuclear Chemistry. 4 (5–6): 349–353. doi:10.1016/0022-1902(57)80018-9.
- Johnson, G. L.; Leininger, R. F.; Segrè, E. (1949). "Chemical Properties of Astatine. I". Journal of Chemical Physics. 17 (1): 1–10. Bibcode:1949JChPh..17....1J. doi:10.1063/1.1747034. hdl:2027/mdp.39015086446914.
- Dreyer, I.; Dreyer, R.; Chalkin, V. A. (1979). "Cations of Astatine in Aqueous Solutions; Production and some Characteristics". Radiochemical and Radioanalytical Letters (in German). 36 (6): 389–398.
- Aten, A. H. W., Jr. (1964). The Chemistry of Astatine. Advances in Inorganic Chemistry and Radiochemistry. 6. pp. 207–223. doi:10.1016/S0065-2792(08)60227-7. ISBN 9780120236060.
- Nefedov, V. D.; Norseev, Yu. V.; Toropova, M. A.; Khalkin, V. A. (1968). "Astatine". Russian Chemical Reviews. 37 (2): 87–98. Bibcode:1968RuCRv..37...87N. doi:10.1070/RC1968v037n02ABEH001603.
- Fry, C.; Thoennessen, M. (2013). "Discovery of the astatine, radon, francium, and radium isotopes". Atomic Data and Nuclear Data Tables. 09 (5): 497–519. arXiv:1205.5841. Bibcode:2013ADNDT..99..497F. doi:10.1016/j.adt.2012.05.003.
- Rankama, K. (1956). Isotope Geology (2nd ed.). Pergamon Press. p. 403. ISBN 978-0-470-70800-2.
- Lide, D. R., ed. (2004). CRC Handbook of Chemistry and Physics (85th ed.). CRC Press. pp. 14–10. ISBN 978-0-8493-0485-9.
- Stwertka, Albert. A Guide to the Elements, Oxford University Press, 1996, p. 193. ISBN 0-19-508083-1
- Asimov, I. (1957). Only a Trillion. Abelard-Schuman. p. 24.
- Kolthoff, I. M.; Elving, P. J., eds. (1964). Treatise on Analytical Chemistry. Part II: Analytical Chemistry of the Elements. 4. New York: Interscience Encyclopedia. p. 487.
- Larsen, R. H.; Wieland, B. W.; Zalutsky, M. R. J. (1996). "Evaluation of an Internal Cyclotron Target for the Production of 211At via the 209Bi (α,2n)211At reaction". Applied Radiation and Isotopes. 47 (2): 135–143. doi:10.1016/0969-8043(95)00285-5. PMID 8852627.
- Barbet, J.; Bourgeois, M.; Chatal, J. (2014). "Cyclotron-Based Radiopharmaceuticals for Nuclear Medicine Therapy". In R. P.; Baum (eds.). Therapeutic Nuclear Medicine. Springer. pp. 95–104 (99). ISBN 978-3-540-36718-5.
- Wilbur, D. S. (2001). "Overcoming the Obstacles to Clinical Evaluation of 211At-Labeled Radiopharmaceuticals" 4 Nisan 2015 tarihinde Archive.is sitesinde arşivlendi. The Journal of Nuclear Medicine. 42 (10): 1516–1518. PMID 11585866.
- Gopalan, R. (2009). Inorganic Chemistry for Undergraduates. Universities Press. p. 547. ISBN 978-81-7371-660-7.
- Stigbrand, T.; Carlsson, J.; Adams, G. P. (2008). Targeted Radionuclide Tumor Therapy: Biological Aspects 14 Mayıs 2016 tarihinde Wayback Machine sitesinde arşivlendi.. Springer. p. 150. ISBN 978-1-4020-8695-3.
- Gyehong, G.; Chun, K.; Park, S. H.; Kim, B. (2014). "Production of α-particle emitting 211At using 45 MeV α-beam". Physics in Medicine and Biology. 59 (11): 2849–2860. Bibcode:2014PMB....59.2849K. doi:10.1088/0031-9155/59/11/2849. PMID 24819557.
- Lindegren, S.; Bäck, T.; Jensen, H. J. (2001). "Dry-distillation of Astatine-211 from Irradiated Bismuth Targets: A Time-saving Procedure with High Recovery Yields". Applied Radiation and Isotopes. 55 (2): 157–160. doi:10.1016/S0969-8043(01)00044-6. PMID 11393754.
- Yordanov, A. T.; Pozzi, O.; Carlin, S.; Akabani, G. J.; Wieland, B.; Zalutsky, M. R. (2005). "Wet Harvesting of No-carrier-added 211At from an Irradiated 209Bi Target for Radiopharmaceutical Applications" 25 Şubat 2020 tarihinde Wayback Machine sitesinde arşivlendi.. Journal of Radioanalytical and Nuclear Chemistry. 262 (3): 593–599. doi:10.1007/s10967-005-0481-7.
- Balkin, Ethan; Hamlin, Donald; Gagnon, Katherine; Chyan, Ming-Kuan; Pal, Sujit; Watanabe, Shigeki; Wilbur, D. (18 September 2013). "Evaluation of a Wet Chemistry Method for Isolation of Cyclotron Produced [211At]Astatine". Applied Sciences. 3 (3): 636–655. CiteSeerX 10.1.1.383.1903. doi:10.3390/app3030636. ISSN2076-3417.
- Zalutsky, Michael; Vaidyanathan, Ganesan (1 September 2000). "Astatine-211-Labeled Radiotherapeutics An Emerging Approach to Targeted Alpha-Particle Radiotherapy". Current Pharmaceutical Design. 6 (14): 1433–1455. doi:10.2174/1381612003399275. PMID 10903402.
- Wilbur, D. Scott (20 February 2013). "Enigmatic astatine". Nature Chemistry. 5 (3): 246. Bibcode:2013NatCh...5..246W. doi:10.1038/nchem.1580. PMID 23422568.
- Fisher, D. (1995). "Oral History of Dr. Patricia Wallace Durbin, Ph.D." 2 Nisan 2015 tarihinde Wayback Machine sitesinde arşivlendi.. Human Radiation Studies: Remembering the Early Years. United States Department of Energy, Office of Human Radiation Experiments. Retrieved 25 March 2015.
- Vaidyanathan, G.; Zalutsky, M. R. (2008). "Astatine Radiopharmaceuticals: Prospects and Problems". Current Radiopharmaceuticals. 1 (3): 177–196. doi:10.2174/1874471010801030177. PMC 2818997. PMID 20150978.
- Odell, T. T., Jr.; Upton, A. C. (2013) [Softcover reprint of the hardcover 1st edition 1961]. "Late Effects of Internally Deposited Radioisotopes". In Schwiegk, H.; Turba, F. (eds.). Radioactive Isotopes in Physiology Diagnostics and Therapy [Radioaktive Isotope in Physiologie Diagnostik Und Therapie]. Springer-Verlag. pp. 375–392 (385). ISBN 978-3-642-49477-2.
- Keller, Cornelius; Wolf, Walter; Shani, Jashovam. "Radionuclides, 2. Radioactive Elements and Artificial Radionuclides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.o22_o15.