Termodinamiğin ikinci yasası
Termodinamiğin ikinci yasası veya Isıldevinimin ikinci yasası, izole sistemlerin entropisinin asla azalmayacağını belirtir. Bunun sebebini izole sistemlerin termodinamik dengeden (maksimum entropi aşaması) spontane olarak oluşmasıyla açıklar. Buna benzer olarak sürekli çalışan makinelerin ikinci kanunu imkânsızdır.
Termodinamiğin ikinci yasası deneysel olarak bir ısı bilgisi önermesi olarak kabul edilir fakat bu yasa altında yatan istatistiksel kuantum mekaniğiyle anlaşılabilir ve açıklanabilir. İstatiksel mekanik literatüründe entropi, makroskopik evrelerde mikroskobik gruplaşmaların ölçümü olarak ifade edilir. Çünkü ısıbilgisinin denge, dengede olmayan duruma göre büyük miktarda mikroskopik dizilişe sahiptir. Bu maksimum entropiye sahiptir ve ikinci yasayı takip eder çünkü düzensiz yalnız değişim kısmen sistemin ısı bilgisinin dengesini geliştirmesini sağlar.
Zamana bağlı bir ifade olarak; sıcaklık, basınç ve kimyasal potansiyel ısıbilgisi dengeye doğru izole edilmiş ve yerçekiminin önemsiz olduğu sistemde azalır.
İkinci yasa farklı birçok şekilde açıklanabilir ama ilk formülasyon 1824 yılında Fransız bilim adamı Sadi Carnot tarafından yazılmıştır. Ikinci yasanın ilk ifadeleri yalnızca yatay düzlemde (yerçekimisiz alanda) doğrudur. Ikinci yasa, iç enerji U’ ya eşit olarak kapsamlı özelliklerin fonksiyonu olarak yazılabilir. (Kütle, hacim, entropi,)
Tanımı
Termodinamiğin birinci yasası, termodinamik enerjinin (iç enerji olarak da bilir bütün ısıbilgisi sistemler bilinmeyen klasik mekanikler hariç) basit tanımını ve doğadaki enerji korunumunu sağlar.
Birinci yasadaki enerji konsepti doğal süreçteki gözlemleri hesaplayamaz. Örneğin ısı her zaman istemsizce yüksek sıcaklıktan düşük sıcaklığa doğru akar (dışarıdan iş yapılmadığı sürece). Birinci yasa başlangıç ve son durumlardaki değişimin simetrik olduğunu açıklar. Bunun açıklanmasındaki anahtar durum ısıbilgisinin ikinci yasası boyunca yeni fiziksel özelliğin tanımı entropidir. Tersine çevrilebilir durumda, kuzeyde entropideki artış (dS) kuzeydeki ısı transferinden (δQ) kapalı sistemdeki sıcaklığa (T) bölümümden elde edilebilir.
Korunumlu entropi sistemindeki iç ısıbilgisi denge zamana bağlı değildir. Korunumlu sistem birbirinden ayrılmış başlangıç sistemlerden oluşur ama hepsi kendi dengesine sahiptir. Parçacıklar tekrar hareket ettirilirse önceki sistemler genel bir etkileşim içinde olacaktır ve kendi yeni son ısıbilgisi sistemini oluşturacaktır. Başlangıç entropiler son entroplerden azdır. Eğer başlangıç entropilerinin hepsi aynı değerdeyse, başlangıç ve son entropileride aynı olacaktır.
Vücuttaki temel denge başkasıyla, kesinlikle birçok emprik sıcaklık ölçüsü vardır. ısıbilgisi sistemin arasındaki temel denge eşit derecelerde sonlanır. Isıbilgisinin başlangıç yasası kısa durumlarda iki ortamın aynı derecelerde recogne etmesine izin verir.
İkinci kural, ünlü bir sıcaklık ölçeğine izin verir. Bu ölçek kesin, ısıbilgisi sıcaklık ve herhangi bir özel, bağımsız ısıbilgisi sistemin özelliklerini tanımlar.
Isıbilgisinin 2. Kuralı birçok özgül yolla açıklanabilir. Bunların en önemlilerin durumu: “Rudolph Clasius” (1854), “Lord Kelvin” (1851) ve “Constantin Caratheodory” (1909) tarafından açıklanmıştır. Bu ifadeler, kesin süreçlerin olanaksızlığı ilkesine dayanarak genel fizik terimlerine dayanır. “The Clasius” ve “the kelvin” ifadeleri eşdeğer olarak gösterilir.
Carnot’s prensibi
Isıbilgisinin 2. Yasasının tarihsel kökeni Carnot’s prensibi'dir. Bu prensibi, Carnot makinesi döngüsünü gösterir. Carnot makinesi; ısı ve iş aktarımlarının birbiri içinde sürekli kendi iç ısıbilgisi dengede almasını düzenler. Bu makine, ısı makinelerinin verimliliğiyle ilgilenen mühendislerin ilgisini çeker, idealize edilmiş bir aygıttır. Carnot’s prensibi, kalasik teorisi caddice anlaşıldıktan sonra ve termodinamiğin 1. Kanununun ve entropinin matematiksel izahından önce tanıtılmıştır. 1. Kanunun yorumlanması. Termodinamiğin 2. Kuralının anlaşılmasını kolaylaşmıştır. Bu, bugün için bile hâlâ geçerlidir.
Quasi-statik veya tersinir Carnot döngüsünün verimliliği, sadece iki ısı kaynağının sıcaklığına ve çalışan kaynağın serbestliğine bağlıdır. Bir Carnot makinesi, bu iki sıcaklığın kullanılmasıyla en verimli şekilde kullanılabilir.[1][2][3][4][5][6][7]
Clausius ifadesi
Alman bilim insanı Rudalf Clausius, ısı ve iş aktarımlarını inceleyerek, ısıbilgisinin 2. Yasasını kurmuş oldu.[8] (1850) onun bu yasayı açıklaması "Clausius ifadesi" olarak bilinir:(1854 Almanya)
Isı, hiçbir zaman soğuk bir cisimden ılık bir cisme bir takım değişiklikler olmadan geçmez.[9]
Isı, sıcak bölgelerden soğuk bölgelere aniden ve iş yapmadan geçemez. Bu, sıradan bir donma olayıyla kanıtlanabilir. Bir dondurucu içinde, ısı soğuktan sıcağa ve sadece dışarıdan bir kuvvet uygulandığında geçebilir.
Kelvin ifadesi
Lord Kelvin 2. kanunu şu şekilde ifade etmiştir:
Donuk meteryal aracılığıyla, etrafındaki en soğuk nesne vasıtasıyla soğutulmuş herhangi bir maddeyi türetmek imkansızdır.[10]
Planck prensibi
1926’da, Max Planck termodinamik temelleri hakkında önemli bir makale yazdı.
Bu formülasyon, ısı ve sıcaklıktan ya da entropiden bahsetmedi, ve dolaylı olarak bu kavramlara bağlı değildi; fakat 2. Kanunun içeriğini taşıyordu. Bağlı olduğu ifade: “sürtünme kuvveti asla pozitif iş yapamaz” dı.[13] Planck, kelimelerin eski biçimlerini kullanarak şunu yazdı: “Isının sürtünme tarafından üretimi tersinir değildir.” [14]
Caratheodory prensibi
Constantin Caratheodory, ısıbilgisi saf matemetic aksiyemura bağlı olarak formüle etti. Onun 2. Kanunla ilgili ifadesi "Caratheodory prensibi" olarak bilinir.[15]
Caratheodory adyabatik erişebilirlik kavramını ilk kez tanımladı ve klasik ısıbilgisinin alt kategorilerini sınıflandırdı.[16]
Bunlar “geometric ısıbilgisi” olarak adlandırılır ve enerjinin quasi-statik olarak transferinin miktarı prensibini taktik Eder. (Çünkü ısı holonomic bir süreçtir. .)[17]
Caretheodory’nin Prensibi 2. Kanunu ifade Eder ve Clausius ya da Kelvin-Planck ifadesine eşdeğerdir. 2. Kanunun tümiçeriğini almak için Caratheodory Prensibi, Planck Prensibi ne ihtiyaç duyar. Isokharic iş, her zaman başta kendi iş ısıbilgisi denkliğine sahip kapalı sistemin iç enerjisini artırır.[11][12][18][19]
Clausius ve Kelvin ifadelerinin eşitliği
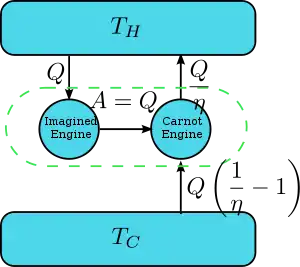
Bir motorun Kelvin ifadesiyle çalıştığını düşünelim. Mesela biri ısıyı tüketiyor ve bunu bütünüyle bir “iş’e döünüştürüyor. Bu yeni yapılmış makinenin net ve biricik etkisi iki motor içerir. Aktarılmış ısı:
Sonuç olarak Kelvin ifadesinin aykırılığı, Clausius ifadesinin aykılırlığı anlamına da gelir; yeni Clausius ifadesi, Kelvin ifadesini de ima Eder. Bunu ayrı şekilde Kelvin ifadesi, Clausius ifadesini ima Eder şekilde de bulabiliriz. Bu yüzden bu iki ifade eşdeğerdir.
Yerçekimi sistemleri
Yerçekimsiz sistemlerde, nesne her zaman pozitif ısı kapasitesine sahiptir; bu da sıcaklığın enerji ile yükseleceği anlamına gelir. Bu yüzden, enerji yüksek sıcaklıktaki nesneden düşük sıcaklıktaki nesneye geçtiğinde kaynak sıcaklık düşer. Buna rağmen lavabo sıcaklığı yükselir. Sonuç olarak; sıcaklık farklılıkları zamanla azalma eğilimindedir.
Ancak, bu yerçekimi kuvvetinin önemli olduğu sistemlerde her zaman geçerli olan bir durum değildir. Kara delikler en göze çarpan örneklerdir ve teoriye göre kara delikler negatif ısı kapasitesine sahiptirler. Kara deliklerin büyüklükleri arttıkça, sahip oldukları enerji de artar ama sıcaklıkları düşer. Sonuç olarak, samanyolundaki süper büyük kara deliğin sıcaklığı 10-4K varsayılır, bu sıcaklık kozmik mikrodalga arka plan sıcaklığı olan 2,7 K'den çok düşüktür, fakat bu kara deliğin düşük olan sıcaklığı daha çok azalır çünkü kozmik mikrodalga arka plan fotonlarını absorbe ettiğin için kütlesi artar. Bu yüzden yerçekiminin olduğu ortamlarda kütle ve enerji eşit olarak dağılmaz.
Sürekli hareket yasası
İkinci yasanın oluşturulmasından önce, sürekli hareketli makinelerinin icadıyla ilgilenen pek çok insan, makinenin gücü ile sistemin büyük iç enerjisinin farkını alarak ısıbilgisinin birinci yasasının kısıtlamalarından kaçınmaya çalışmışlardır. Bu tür makinelere “devridaim makinesi” denir. İkinci kanun bu makinelerin imkânsızlıklarını açıklamıştır.
Carnot kuramı
Carnot teoremi (1824) her makineyi maksimum verimlilikle sınırlandırır. Verimlilik yalnızca sıcak ve soğuk termal rezervuarlar arasındaki sıcaklık farkına bağlıdır. Carnot kuramı aşağıdaki ifadelere dayanmaktadır:
- İki ısı rezevuarı arasındaki tek yönlü bütün ısı motorları, aynı iki rezervuar arasındaki bir Carnot motorundan daha az verimlidirler.
- İki ısı rezervuarı arasındaki tek yönlü bütün ısı motorları, aynı iki rezervuar arasındaki bir Carnot motoruyla eşit verimliliktedirler.
Carnot’un ideal modelinde kalorik ısı, tersinir hareket döngüsünü eski haline çeviren işe dönüştürüşür. Ancak Carnot, mekanik işe dönüşmeyen ısı kayıplarının olduğunu varsaymıştır. Sonuç olarak Carnot döngüsünün çevrilebilme özelliğini gerçekleştiren gerçek ısı makinesi yoktur ve bu makine çok verimsizdir.
Clausius eşitsizliği
Clausisus teoremi (1854) döngü sürecine dayanır.
Eşitlik tersinir durumu gösterir ve “<” işareti tersinemez durumlarda yer alır. Tersinir durum entropi hal fonksiyonunu açıklamak için kullanılır. Çünkü döngüsel işlemlerde hal fonksiyonunun değişimi sıfırdır.
Termodinamik sıcaklık
Herhangi bir ısı motoru için verimlilik:
A: birim döngüde yapılan iş Carnot önermesi tersinir aynı iki ısı rezervuarlarını çalıştıran tersinir makinelerin eşit verimlilikte olduğunu ifade eder. Sonuçta T1 ve T2 sıcaklıklarında çalışan herhangi tersinir ısı makinesi bu sıcaklıklarda aynı verimlilikte olmak zorundadır. Bu yüzden verim sıcaklığa bağlı fonksiyondur.
Ayrıca T1 ve T3 sıcaklıklarında çalışan tersinir bir ısı makinesinin T1 ve ara sıcaklık olan T2 arasındaki verimliliğiyle T2 ve T3 arasındaki verimliliği eşit olmak zorundadır.
Suyun üç sıcaklık noktalarından sabit referans sıcaklık olarak düşünülürse,
Sonuçta ısıbilgisi sıcaklık,
f fonksiyonu ısıbilgisi sıcaklık fonksiyonu varsayılır,
- ,
Ve referans sıcaklık T1 ‘in değeri 273,16 olur.
(Herhangi referans sıcaklığı ve diğer pozitif sayısal değerler Kelvin cinsinden olmalıdır.).
Entropi
Clausıus a göre aşağıdakı eşitlik tersine de eşitlenebilir.
Bu demektir ki çizgi integralı bağımsiz yoldur.
Boylece durum foksiyonu olan ‘entropy’ aşağıdaki gibi tanımlayabiliriz.
Bununla birlikte yukardaki formülün integralini alarak sadece entropy’nin farkını elde edebiliriz. Mutlak değeri elde etmek için muhteşem kristalle içinmutlak sıfırda s=0 olan ısıbilgisinin 3. Yasasına ihtiyacımız vardır.
Herhangi çevrilemeyen süreçte, entropy bir durum foksiyonu olduğu için gerçek olmayan cevrilebilen süreçte birlikte başlangıç ve terminal durumları arasında bağlantı kurabiliriz.
Şimdi cevrilebilen süreci çevir denilen cevrilemeyen süreçte kombin et ve Clausius eşitsizliğine başvur.
- Böylece
Eşitlik dönüşümün çevrilebildiği yerlerde olur.
Eğer sürec ısısız bir süreçse bu yüzden
Ekserji, mevcut kullanılabilir iş
Önemli ve idealleştirilmiş özel durum ikinci yasa olan isale edlimiş sisteme (tüm sistem veya evrensel) başvurulmak içindir. bu işlem iki parttan oluşur. Bunlar ilgilenilen alt-sistem ve çevresel alt-sistemdir. Bu çevresel limitsiz sıcaklık haznesi olarak düşünülebilir.
TR sıcaklıgı ve PR basıncı altında. Ayrıca ne Kadar ısı transefer olsa da sub-systeme sıcaklık her zaman TR kalır ayrıca hacim ne kadar degişsede PR de her zaman sabit kalır.
Ne değişiklik olursa olsun dS ve dSR de ikici yasaya göre Stot olan isole total sistem azalmamaktadir.
Termodinamiğin ilk yasasına göre dU değişimi alt-sistemin iç enerjisinde eşittir su-systeme eklenilen toplam ısı δq eksi alt-sistem tarafından yapılan herhangi iş δw ve artı alt-sisteme giren herhangi net kimyasal enerji d ∑μiRNi yani,
(μiR kimyasal türlerin kimyasal potansiyelleri dışçevrede) şimdi rezervuarı terk eden ısının alt-sisteme girişi
Herhangi alt-sistem tarafından net iş δw uymalıdır ki
Bu kullanışlıdır ayırmak için alt-sistem tarafından yapılan işi δw ve alt-sistem tarafından yapılan işi δwu ve alt-sistem tarafından yapılan pR dV genişler dış çervre basıncına karşı. Aşağıda verilen ilişki kullanışlı iş için verilmiştir.
ısıbilgisi potansiyelin tam türevini tanımlamak için alt-sistemin mevcut veya exergy E si demek uygundur.
Bu yüzden ikinci yasa ima eder herhangi subsystemine ve limitsiz sıcaklık ve basıncına ayrılmış süreç için
İkinci yasa tahmin eder E deki azalışı değişmeyen ve değişen süreçler için
- Eşdeğer olduğunda
Bu açıklama 2.yasayı faydalı hale getirmek için desing motor çalışmasına makroskopıc değerlere izin verir.Bu değişiklikler referans durumuyla dengeye ulaşan durumlar altındaki sistemler tarafından tahmin edelir. (Bakıncı2.yasa etkisi).bu yaklaişım 2. yasanın mühendislik pratiklerinde çevre hesaplarında ekoloji sistemlerinde ve öbür hesaplarda yarar sağlar.
Tarihçe
Isının mekanik işe dönüşümüyle ilgili ilk teori Nicolas Leonard Sadi Carnot tarafından 1824 yılında ortaya atıldı. Carnot ilk kez, bu dönüşümün verimliliğinin makine ile çevresi arasındaki sıcaklık farkına bağlı olduğunu fark etti.
Rudolf Clausius, Prescott Joule’in enerjinin korunumu hakkındaki çalışmalarını da göz önünde bulundurarak 1850 yılında ikinci kanunu formülize etti. Bu kanuna göre, bugün bilinenin aksine, ısı kendiliğinden soğuktan sıcağa doğru akmazdı. Buradan hareketle Rudolf, entropinin tanımını ve Sadi Carnot’un ilkelerini tanımlayabildi.
19. Yüzyılda yayımlanan Kelvin Planck’ın açıklaması şöyleydi: “Hiçbir cihaz tek başına bir rezervuardan ısı alarak periyodik olarak çalışamaz ve iş elde edemez.” Bu açıklama Clausius’un açıklamasıyla eşdeğerdi.
Boltzmann’ın yaklaşımı için ergodik hipotez de oldukça önemliydi. Bu hipotez şöyle söylüyordu: “Küçük alanlardaki bölgelerin evrelerinin gerçekleşmesi için gereken zaman, bu bölgenin hacmiyle doğru orantılıdır.” Aynı zamanda ortalama zaman ve statistik grupların ortalaması da eştir.
Sadece klasik sistemlerde değil, quantum mekaniğinde de entropiyi maksimuma çıkarma eğilimi olduğunu görebiliriz. Bu yüzden ikinci kanunda verilen ilk koşullar düşük entropiyle verilir. Sonuçlar üst sınıf izole edilmiş quantum sistemleri için geçerli olur. (Örneğin konteynr içindeki gaz) Bütün sistemde hiç entropi olmasa ve sistem saf olsa bile gaz ve konteynır arasındaki karmaşıklık gazın yerel entropisindeki artışı verir. Bu sonuç quantum ısıbilgisinin en önemli sonucudur.
Bugün, evrenin ilk zamanlarında neden düşük entropiye sahip olduğunu anlamak için oldukça çaba harcanıyor.
Yasal olarak geçersiz açıklama
İkinci kanun birkaç maddeyle özetlenebilir;
- Tek başına bir rezervuar kullanarak periyodik bir iş elde etmek imkânsızdır. (Kelvin, 1851)
- Isıyı motor kullanarak sıcaklığın az olduğu yerden çok olduğu yere aktarmak imkânsızdır. (Clausius, 1854)K
- Eğer ısıbilgisi iş için sonlu bir oran kullanılıyorsa, sonsuz bir enerji kullanılmıştır.
Matamatiksel açıklama:

1856 yılında Rudolf Clausius “ısının mekanik kuramının ikinci ana önermesi” adını verdiği kuramını şu şekilde açıkladı:
Q=ısı, T=sıcaklık ve N=karşılığı verilmemiş dönüşümlerin eşdeğeri 1865’de Clausius bu eşdeğeri entropi olarak tanımladı. Clausius sonuçta şu yargıya vardı: “Evrenin entropisi maximum olma eğilimindedir.” Bu önerme ikinci kanunun en bilinen kısmıdır.Bu tanım çok basit durabilir ancak tabii ki kompleks bir tanımın sadeleştirilmiş halidir. Zaman varyasyonu açısından, ikinci kanunun matematiksel ifadesi
S=Sistemin entropisi T=zaman Bu eşitlik geri dönüşebilen süreçler için kullanılır.Eğer süreç geri dönemezse >-işaret alır. İzole edilmiş sistemler için ikinci kanunun alternatif bir formulü vardır:
- eğer ise.
- =entropi oranlarının toplamı
Bu formulün avantajı entropi üretiminin etkilerini göstermesidir. Entropi üretimi oranı makinelerin etkisi açısından çok önemlidir. İkinci kanunun kapalı sistemler için formülü:
- Eğer ise.
Q=sisteme akan ısı.
- : Isının sisteme girdiği noktadaki sıcaklık
Eğer sisteme belirli noktalardan ısı verilirse, bu değerlerin toplamının alınması gerekir. Açık sistemler için denklem (bileşen değişim imkânı var.)
- Ancak
Buradaki, sisteme giren madde miktarıyla doğru orantılı olarak sisteme giren ancak kullanılmayan enerji miktarını (entropi) simgeler. Bu, kullanılmayan enerjinin zamana göre türeviyle karıştırılmamalıdır. Eğer gereken yerlere istenen miktarda madde sağlanırsa bunların katkılarını hesaba katmak adına hepsinin toplamı alınır.
İstatistiksel mekanikte ikinci yasa için verilen açıklamada; maddenin atom ve moleküllerden oluştuğunu ve bunların da sabit bir yörüngede hareket halinde olduğu varsayımını kabul ederiz. Belirli durumlarda ve hızlarda sistemdeki her bir parçacık için verilen durumun adı sistemdeki ‘microstate’ (anlık durum) olarak adlandırılır ve sabit hareketten dolayı, sistem kendi ‘microstate’ini sürekli yeniliyor. İstatistiksel mekaniğin bir başka varsayımı ise dengede olan sistemlerde her bir ‘microstate’in oluşma ihtimali birbirine eşit olur ve bu varsayımdan yola çıkılacak olunursa ikinci yasanın mutlaka istatistiksel bir görüşe de sahip olması gerektiği kanısına varılabilir. N’nin sistemdeki parçacık sayısı olduğunu düşünürsek, istatistiksel değişim miktarını da 1/√N ile hesaplayabiliriz. Günlük hayatta, çıplak gözle görebildiğimiz olayları düşündüğümüzde, ikinci yasanın işlev dışı kalma ihtimali sıfır. Ancak, az miktarda parçacığı olan sistemler için, ısıbilgisi kat sayılar (entropi dâhil), ikinci yasanın kuramda öngördüğü rakamlara göre ciddi bir sapma gösterebilir. Isıbilgisi kuramı istatistikler varyasyonlarla ilgilenmez.
İstatistiksel mekaniğin kökeni
Loschmidt paradoksuna rağmen, ikinci yasanın kökeninin geçmişe dair bazı varsayımlara sahip olması gerekmektedir. Tabi sistemin geçmişte bazı durumlarda bağımsız hareket ettiği de olmuştur. Bu durum basit bir olasılık hesabıyla hareket etmemize imkân sağlar. Bu durum limit durumu olarak da bilinir ve ikinci yasa, eninde sonunda başlangıç değerinin neticesinde ortaya çıkmıştır hatta muhtemelen evrenin oluşması ile sonuçlanan büyük patlamanın bile başında.
Verilen varsayımlardan yola çıkıldığında, istatistiksel mekanikte bahsedilen ikinci yasa tam anlamıyla doğru varsayılmamaktadır. Bunun yerine temel bir kavramın sonucu olarak kabul edilir. İkinci yasanın ilk kısmında bahsedilen ısıca yalıtılmış sistemlerin entropisi sadece öncelikli denk olasılığın göz ardı edilebilecek bir kısmını artırır varsayımı ancak ısıl denge halindeki bir sistemi kısıtladığımızda ortaya çıkar. Isıl dengedeki izole bir sistemin entropisinin depoladığı enerji miktarını ile gösterecek olursak,
- İle arasındaki kısa aralıktaki kuantum durumlarının sayısıdır. İse gözle görülür derecede fakat küçük bir miktar enerji aralığını simgeler. Kesin bir dille konuşmak gerekirse entropimiz seçtiğimiz değerine bağlı olarak değişim gösterir. Yalnız, ısıbilgisi limiti düşündüğümüzde (sistemin ulaşabileceği maksimum genişlik) seçtiğimiz belirli bir entropi (hacmi ve kütlesi belirli) değerinden etkilenmez.
Farz edelim ki boyutu belirli bir sayıda değişkenle sabit tutulmuş izole bir sistemimiz var. Bu değişkenler, sistemin hacmini, kütlesini ya da pistonların konumunu belirliyor olabilir. Değeri sistemdeki bahsettiğimiz değişkenlere bağlı olacaktır. Eğer bir değişken sabitlenmemişse (pistonun ulaşacağı en yüksek nokta gibi) sistemdeki dengeden dolayı, bağımsız değişkene etki yapacak olan değeri değişkeni olabilecek en muhtemel değerde sabitleyecektir.
Eğer değişken başlangıçtan itibaren sabit bir değere sahipse ve yeni dengeye an itibarıyla ulaşılmışsa değerini maksimuma ulaştırmak için değişken kendini ayarlayacaktır. Denge halinde değilken sistemin entropisi,
Isıl dengede, iç enerji aralığı olan durumların oluşma olasılığı. Eğer böyle bir durum olursa S’nin tanımı da önceki ısıl denge durumunda kullanılan açılım ile aynıdır. Denge durumunda başladıktan bir süre sonra değişken sayısındaki sınırlamayı kaldırdığımızı varsayalım. Bundan hemen sonra da sisteme kadar microstate (yapı oluşturma) eklediğimizde ve sistem hâlâ denge durumuna ulaşmadığında sistemin çalışabilir durumda olma ihtimali. Daha önce en son denge halinde gördüğümüz gibi entropi ya önceki denge durumunda kalacak ya da öncekine nazaran ufak bir artış gösterecektir. Geri Dönüştürülebilir İşlemler için Entropideki Değişim
İkinci yasanın ikinci bölümünde de belirtildiği üzere, geri dönüşümü mümkün olan yöntemlerdeki entropi değişimi şekildeki gibidir:
Bu durumda sıcaklık ise,
Sistemde rolü olan bazı dış değişkenler de mevcut. Genel olarak bunların sistemi değiştirme imkânı var çünkü enerji dışarıdan sağlanır ve sistem için her şey demektir. Kuantum mekaniğinin ısı değişimsiz kuramına göre, neredeyse hiç değişmeyen bir sistemin durumunun limitini aldığımızda, sistemin enerji özünde bir değişim olmaz. Genel haliyle kuvvet, X, dış etkenleri ayarlayan değişken ise x olarak gösterildiğinde tabiri sistem tarafından yapılan saf işi verir. Buradaki değişim ise dx ile gösterilir. Mesela x e hacim X e de basınç dememiz gibi. Sistemdeki enerji miktarı ise;
- Genişliği boyunca sistem herhangi bir enerji durumunda olabileceği için, sistemdeki genel kuvveti tahmini değerler içinde yazacak olursak;
Ortalama değeri değerlendirecek olursak, değerini parçalara ayırıyoruz. Bunun nedeni olarak da ve aralığı içinde değere karşılık gelecek kaç tane değer olduğunu kontrol ediyoruz. Karşımıza çıkan değere de : diyoruz. Sonuç olarak elimizde, Ortalama gücü genellemek adına da şöyle yazabiliriz;
Bu açılımı entropinin türeviyle bağdaşlaştırabiliriz. Denklemde x i x + dx diye değiştirdiğimizi varsayalım. Bu durumda değeri de etkilenir x e bağlı olduğundan ve de ile arasındaki değerleri alabilir.
Yukarıdaki denklem ele alındığında eğer durumu sağlandığında bütün enerji değerleri ile değerleri arasında yerini alır ve değerinin artışına yardımcı olurlar. Sistemlerin başlangıç enerjilerinin toplamı aşağı yukarı olur ve aralarındaki fark da
- ile ifade edilir. Elde edilen sonuç ise değerine yapılan net katkıyı gösterir. Eğer değerden daha yüksekse, E ile arasında bir değere sahip enerji açığa çıkacaktır. ve toplamlarda da sayılan enerji değerleri özetlenecek olursa şu şekilde gösterilebilir:
- değerinin logaritmik türevi ise;
İlk terim bazı durumlarda sınırları aşabileceği için alternatif olarak kullanabileceğimiz,
Ve
Bu ikisini bir araya getirmeye çalıştığımızda ise elimize geçen denklem;
Kanonik set ile ifade edilen sistemlerin türevleri
Sisteme giren ya da sistemden çıkan herhangi bir ısı var ise, denge halinde bu ısıyı T ile gösterip, bu ısının sistemdeki belirli yerlere dağılma olasılığının Kanonik Set ile bulunuşu;
Temel olasılık hesabından bilindiği üzere bağımsız bir olayda meydana gelmesi ihtimal dâhilinde olan olayların olasılıkları toplamı 1 etmelidir. Bizim denklemimizde de Z değerlerin toplamının 1de buluşmasını sağlayan temel faktördür. Bu tarz fonksiyonlara da ayrılma fonksiyonu denir. Dış etkenlere bağımlı ısının değişimi ve bunun enerji seviyesine olan katkısını gösteren genel formül;
Bu denklemden
- değerini elde ettiğimizde elimizde kalan son değer,
Kuantum mekaniğinin birleştiriciliği
Kuantum mekaniğinin temel yapıtaşlarından biri olan ikinci yasaya baktığımızda geçiş olasılık matrisi ve zamanla gelişen bir birim var. İkinci yasanın bu denli geniş kapsamlı olması onu bir bakıma diğer önerme ve yasaların birleştiricisi de yapar. Genellenebilirliği ve birleştiriciliği açısından herhangi bir ileri kanıta veya desteğe ihtiyacının olmaması evrensel genel geçer bir üne ve güvene sahip olmasının da bir nevi kanıtıdır.
Dengede olmayan durumlar
Termodinamik analiz amacıyla yaklaştığımızda aslında uzay zaman çizgisinden rastgele seçilmiş herhangi bir olayın ısıbilgisi dengede olduğu düşünülür. Daha geniş bir perspektiften bakıldığında ise uzay-zaman çizgisinde bulunan, kısacası evrendeki hiçbir şey tam anlamıyla ısıbilgisi denge halinde değildir hiç de olmamıştır. Bir diğer ayrıntı ise termal dengedeki bir sistemin istatistiksel olarak denge durumundan çıktığı anlar olması doğaldır. Bazı karşılaşması güç olaylarda ise, sıcak parçacıkların soğuk parçacıklardan enerji çaldığı ve bu sayede ortamdaki sıcak kısmın daha sıcak soğuk kısmın ise giderek daha soğuk bir hal aldığı gözükmüştür, son derece kısa bir zaman aralığında olsa bile.
Fiziğin dâhil olduğu ve gerçekleşmesi kâğıt üzerinde mümkün olan bazı olaylar vardır ki bilindik ısıbilgisinin denge kurallarının çok ötesinde davranış sergileyen. Dalgalanma önermesi ise bir sistemin dengeden uzak kaldığı süre zarfı boyunca entropisindeki değişim miktarının olasılığının rakamsal olarak yaklaşık bir değerini verir.
Geçmişten bugüne
Isıbilgisinin ikinci yasası bir fizik yasasıdır ve geri dönüşlü zaman kavramını kapsamaz. Aslında geçmişte bu yasanın geliştirilmesi açısından zamanda ileri ve geri gidildiğinde ne gibi farklılıklar olabileceğine dair bir açıklama eklenilmesi gerektiği önerilse de günümüze kadar pek bir değişim sergilememiştir.
Maxwell’in İblisi
James Clerk Maxwell, A ve B şeklinde ikiye bölünmüş bir konteynır hayal etmiştir. İki parça da eşit miktarda ve eşit sıcaklıktaki aynı gazla doldurulmuş ve yan yana bekletilmektedirler. İki taraftaki molekülleri de izlerken hayali iblisin iki tarafta da savunma yaptığını görür. A’daki iblis daha hızlı hareket ettiğinde B’ye uçan moleküller olur ve A yavaşladığından B zaman içinde daha fazla ısınır ve A’daki ısı düşer. Bu ısıbilgisinin ikinci yasasına göre tamamen zıt bir durumdur.
Loschmidt paradoksu
Loschmidt paradoksu geri döndürülme paradoksu olarak da bilinir. Zamanla simetrik dinamiklerin geri döndürülebilen işleme bir faydası olma ihtimalinin düşünülmesine karşı çıkılmaktadır. Bu bizi, çıplak gözle işleyişini görebildiğimiz sistemlerin davranışlarını açıklamak adına ısıbilgisinin ikinci yasasını kullanmak için bilinen bütün yöntemlerden bir adım daha öne götürmektedir. Bu yöntemlerin neredeyse hepsi kuramdan gücünü almakla beraber bazıları kendi aralarında çelişmektedir. Bu yüzdendir ki onlara paradoks deniyor.
Gibbs paradoksu
İstatistiksel mekanikte, birbirinden ayrılabilen parçacıklardan oluşan ideal gazın entropisinin basit bir türevini aldığımızda bunun ısıbilgisinin ikinci yasasının bazı kurallarını çiğnemesinin yanı sıra kanonik sete dayanması ise bizi bu paradoksun Gibbs paradoksu olarak adlandırmaya itmektedir.
Parçacık türünün entropiyi direkt olarak etkilemediği fark edildiğinde bu paradoks durdurulmuştur. Bilindik bir tabir ile bu, kuantum mekaniği ile bağdaştırılan ve parçacıkların birbirinden farksızlığı ile açıklanan bir tanımlamadır.
Yineleme teoremi
Yineleme kuramı der ki belirli sistemler, üzerlerinden yeteri miktarda uzun bir zaman geçtiğinde başlangıç durumlarına son derece yakın bir konuma gelirler. Bu yenileme zamanı yenilenene kadar akıp giden zaman tabirle bulunmaktadır. Bu formül enerjinin korunduğu bütün fiziksel sistemlere uygulanabilir. Yineleme kuramı belli ki ısıbilgisinin ikinci yasasıyla bir çelişki içindedir. İkinci yasa der ki bir sistem çoğu durumda öyle yüksek enerji seviyelerine gelir ki; geri dönüşü mümkün olmayan kazançlar veya kayıplar yaşanır ve sistem bir daha asla eski haline dönemez. Bu paradoksu çözüme kavuşturmanın birden çok yolu var ancak hiçbiri evrensel olarak kabul görmemiştir. Bunlardan bir tanesi, yinelenme için gereken zaman o kadar büyüktür ki; ne kadar uzun zaman geçerse geçsin, sistemin başlangıç haline yaklaşması bile gözlenememektedir.
Kâinatın geleceği
Geçmişten gelen bir uyarı olarak evrendeki entropi miktarı zaman içinde giderek arttığı için, etrafımızdaki enerji miktarı da zaman içerisi azalacak ve “ısı ölümü” yaşanacağı ve bunun bir sonucu olarak da fiziksel anlamda hiçbir iş yapılamayacak ve dünya üzerindeki hayatın sona ereceği de söylenenler arasındadır. Bir yandan da sürekli genişleyen bir evrenin içinde olduğumuzu düşünecek olursak ısıl dengeye hiçbir zaman ulaşılamayacak ve bu “ısı ölümü” kuramı çürütmeye yetecektir.
Kainatın şu anki durumunu göz önüne alacak olursak, öne çıkan fikirlerden biri kainat bize muhtemelen evrendeki bütün enerji kaynaklarının yok olacağı yıldızların bile söneceği bir gelecek sunacaktır. Bununla beraber, belki de küçük parçacıklardan oluşan sistemlerden az miktarda da olsa enerji üretmek mümkün olur ve son derece düşük enerji seviyelerinde de olsa ‘ilginç olaylar yaşanmaya devam edebilir.’
Kaynakça
- Carnot, S. (1824/1986).
- Truesdell, C. (1980), Chapter 5.
- Adkins, C.J. (1968/1983), s. 56–58.
- Münster, A. (1970), s. 11.
- Kondepudi, D., Prigogine, I. (1998), s.67–75.
- Lebon, G., Jou, D., Casas-Vázquez, J. (2008), s. 10.
- Eu, B.C. (2002), s. 32–35.
- Clausius, R. (1850).
- Clausius, R. (1867).
- Thomson, W. (1851).
- Münster, A. (1970), s. 45.
- Lieb, E.H., Yngvason, J. (1999), s. 49.
- Truesdell, C., Muncaster, R.G. (1980). Fundamentals of Maxwell's Kinetic Theory of a Simple Monatomic Gas, Treated as a Branch of Rational Mechanics, Academic Press, New York, ISBN0-12-701350-4, s. 15.
- Planck, M. (1926), s. 457, Vikipedi editörünün çevirisi.
- Carathéodory, C. (1909).
- Buchdahl, H.A. (1966), p. 68.
- Sychev, V. V. (1991). The Differential Equations of Thermodynamics. Taylor & Francis. ISBN 978-1560321217. Erişim tarihi: 26 Kasım 2012.
- Planck, M. (1926).
- Buchdahl, H.A. (1966), s. 69.
