Yörüngesel kuantum sayısı
Bir atomik yörünge için açısal nicem sayısı, yörüngesel açısal devinirliği ve yörüngenin şeklini belirleyen sayıdır. Açısal nicem sayısı bir elektronun eşsiz nicem durumunu tanımlayan ikinci set nicem sayılarındandır (diğerleri esas nicem sayılarıdır; spektroskopik gösterim, mıknastıssal nicem sayısı ve fırıl nicem sayısı). Açısal nicem sayısı; yörüngesel açısal nicem sayısı, yörüngesel nicem sayısı ya da ikinci nicem sayısı olarak da bilinir. ℓ ile sembolize edilir.
Türetim
Bir atomun elektronlarının enerji durumlarıyla ilgili olan dört nicem sayısı seti: n, ℓ, mℓ, and ms. Bunlar bir atomdaki tekil elektronun tamamen ve eşsiz nicem durumunu belirleyerek dalgafonksiyonu ve yörüngesini oluşturur. Schrödinger dalga eşitliğinin dalga fonksiyonu çözüldüğü zaman ilk üç nicem numarasına yönelen üç eşitliğe düşer. Öyleyse ilk üç nicem sayısının denklemleri ilişkilidir. Açısal nicem sayısı aşağıda gösterilen dalga fonksiyonunun kutup parçasının çözümüyle ortaya çıkmıştır. Açısal konsepti anlamaya yardımcı olmak için küresel koordinat sistemini gözden geçirmek veya Kartezyen koordinat sisteminin yanında diğer matematiksel koordinat sistemlerini gösden geçirmek yararlı olabilir. Genelde küresel koordinat sistemi küresel modellerle, silindirik koordinat sistemi silindirik modellerle ve Kartezyen koordinat sistemi genel hacim vs. modellerle ili çalışır.
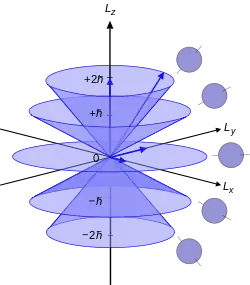
Bir atomik elektronun açısal devinirliği,L, elektronun nicem sayısı ℓ ile takip eden eşitlik ile bağlantılıdır:
ħ İndirgenmiş Plank sabiti, L2 Yörüngesel açısal devinirlik işleticisi ve Elektronun dalga fonksiyonu.Nicem sayısı ℓ her zaman negatif olmayan bir tam sayıdır: 0,1,2,3, vs. (bkz: Açısal Devinirlik Nicelemesi). Çoğu nicem mekaniğine giriş kitabı L‘den bahseder ancak açısal devinirlik işleticisi olarak kullanılmadığı zaman bir anlamı yoktur. Açısal devinirlikten bahsetmenin en iyi yolu nicem sayısı ℓ ‘yi kullanmaktır. Atomik yörüngeler harflerle gösterilen kendilerine has şekillere sahiptir.

s, p, ve d harfleri atomik yörüngenin şeklini tanımlar.
Dalga fonksiyonları küresel uyumluluğun biçimini almışlardır ve Legendre Polinomları ile tanımlanırlar. ℓ’nin farklı değerleriyle ilişkili çeşitli orbitaller ''alt kabuklar'' olarak tanımlanırlar ve (genelde tarihsel sebeplerden) şekildeki harflerle bashedilirler:
ℓ Harf Maks Elektron Şekil İsim 0 s 2 küre (keskin) sharp 1 p 6 ikili halter (temel) principal 2 d 10 dörtlü halter ya da eşsiz şekil bir (dağınık) diffuse 3 f 14 sekizli halter ya da eşsiz şekil iki (esas) fundamental 4 g 18 5 h 22 6 i 26
altkabuğundan sonra gelen harfler, daha önce kullanılanlar hariç, f ‘i alfabetik sıra ile takip ederler.
Harfleri kolay ezberlemek için birkaç (İngilizce) belleteç S. P. D. F. G. H. ... is "Sober Physicists Don't Find Giraffes Hiding In Kitchens Like My Nephew", Smart People Don't Fail, Silly People Drive Fast, silly professors dance funny, Scott picks dead flowers, some poor dumb fool! vs.
Diğer bütün farklı açısal devinirlik durumları 2(2ℓ + 1) tane elektron alabilirler. Bunun sebebi üçüncü nicem sayısı mℓ 'in (z eksenindeki açısal devinirlik vektörünün gevşekçe nicelenmiş yansıması olarak düşünülen) −ℓ 'den ℓ'ye gitmesi ve 2ℓ + 1 tane mümkün durum olmasıdır. Her belirgin yörünge n,ℓ,mℓ zıt fırıllı iki elektron tarafından işgal edilebilir. (ms nicem sayısı ile verilen), toplamda 2(2ℓ + 1) elektronu olan.Tabloda verilen yörüngelerden daha yüksek ℓ ‘si olan yörüngelere güzelce müsaade edilebilir ancak bu değerler şu ana kadar keşfedilen bütün atomları kapsar.
Bilinen bir nicem sayısı n için, ℓ ‘nin mümkün değer aralığı 0 ‘dan n – 1 ‘e kadardır; Öyleyse n = 1 kabuğu sadece bir s altkabuğuna hakim olabilir ve sadece 2 elektron alabilir. n = 2 kabuğu sadece s ve p altkabuklarına ve toplamda 8 elektrona sahip olabilir. n = 3 kabuğu s, p ve d altkabuklarına ve toplamda 18 elektrona sahip olabilir. Genel söylem n ‘inci derecedeki maksimum elektron sayısı 2n2 şeklindedir.
Açısal devinirlik nicem sayısı,ℓ, çekirdeğe doğru olan düzlemsel boğumları yönetir. Düzlemsel boğum; orta noktası tepe ve dip arasında ve büyüklüğü 0 olan bir elektromıknatıssal dalga larak tanımlanabilir. Bir s yörüngesindeki çekirdeğe doğru hiçbir boğum yoktur. Öyleyse açısal nicem sayısı ℓ 0 değerini alır. Bir p yörüngesinde çekirdeği çapralayan bir boğum vardır ve ℓ 1 değerini alır. L ise √2ħ değerini alır.
n ‘nin değerine bağlı olarak, bir açısal nicem sayısı ve takip eden seriler vardır. Hidrojen atomunun dalgaboyları listelenmiştir:
- n = 1, L = 0, Lyman serisi (morötesi)
- n = 2, L = √2ħ, Balmer serisi (görünür)
- n = 3, L = √6ħ, Ritz-Paschen serisi (kızılötesine yakın)
- n = 4, L = 2√3ħ, Brackett serisi (kısa dalgaboylu kızılötesi)
- n = 5, L = 2√5ħ, Pfund serisi (orta dalgaboylu kızılötesi).
Nicelenmiş Açısal Döndürüme Ek
Bilinen iki nicelenmiş açısal döndürümün, ve , toplamı olan bir nicelenmiş açısal devinirlik ;
Nicem sayısı 'nin büyüklük menzili 'den 'ye kadardır. ve özgün açısal döndürüm nicem sayılarının büyüklüklerini temsil eder.
Atomdaki Bir Elektoronun Toplam Açısal Devinirliği

Atomdaki fırıl-yörünge etkileşimine göre yörüngesel açısal devinirlik hem Hamiltonian ile sırabağımsızdır hem de fırıl yapmaz. Bu nedenle zamanla değişir. Ancak toplam açısal devinirlik J Hamiltonian ile öndelenir ve sabittir. J ;
L yörüngesel açısal devinirlik ve S fırıldır. TToplam açısal devinirlik aynı öndelenim ilişkisini karşılar.
takip eden
Ji ; Jx, Jy, ve Jz'yi tanımlar.
Dalgaboyu 'de J 'nin etkinliğinde tanımlanan j ve mj nicem sayıları zamanla sabitlenen sistemi tanımlar.
Yani j toplam açısal devinirlik modeli ve mj 'nin belirli bir eksende yansıması ile ilişkilidir. Nicem mekaniğindeki her açısal devinirlik gibi, J 'nin diğer eksenlerdeki yansıması Jz ile tanımlanamaz çünkü öndelenemezler.
Eski ve Yeni Nicem Sayıları Arasındaki İlişki
j ve mj, birlikte nicem durumunun eşleri üç nicem sayısı ℓ, mℓ ve ms ‘in yerini alırlar (fırılın belirli bir eksen boyunca yansıması).Eski nicem numaraları sonrakiler ile ilişkilendirilebilir.
Dahası j, mj ve eşlersayısının özvektörler aynı zamanda Hamiltonian’ın özvektörleri; ℓ, mℓ and ms ‘in özvektörlerinin doğrusal kombinasyonlarıdır.
Açısal Devinirlik Nicem Sayılarının Listesi
- Fırıl açısal devinirlik nicem sayısı veya basit fırıl nicem sayısı.
- Yörüngesel açısal devinirlik nicem sayısı (Bu makalenin konusu).
- Mıknatıssal nicem sayısı, yörüngesel açısal devinirlik nicem sayısı ile alakalı.
- Toplam açısal devinirlik nicem sayısı.
Tarihçe
Açısal nicem sayısı Bohr atom modelinden süregelmiştir ve Arnold Sommerfeld tarafından oturtulmuştur.[1] Bohr atom modeli atomun spektroskopik analizi ile Rutherford atom modelinin birleştirilmesinden türetilmiştir. En düşük nicem seviyesinin açısal devinirliği sıfır bulunmuştur. Sıfır açısal devinirlikli yörüngeler tek boyutta salınım yapan yükler olarak düşünülmüştür ve sarkaç yörüngeleri olarak tanımlanmışlardır.[2] 3 boyutta yörüngeler büyük bir çemberde salınan zıplama ipine benzeyen çekirdeği çaprazlayan boğumlar içermeyen küresellere dönüşürler.
Ayrıca bakınız
- Açısal devinirlik işleticisi
- Temel nicem sayıları
- Küresel simetri potansiyelinde parçacık
- Nicem sayısı
- Mıknatıssal nicem sayısı
- Temel nicem sayısı
- Fırıl nicem sayısı
- Toplam açısal devinirlik nicem sayısı
- Açısal devinirlik eşleme
- Clebsch–Gordan katsayıları
Kaynakça
- Eisberg, Robert (1974). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles. New York: John Wiley & Sons Inc. ss. 114-117. ISBN 978-0-471-23464-7.
- R.B. Lindsay (1927). "Note on "pendulum" orbits in atomic models". Proc. Nat. Acad. Sci. Cilt 13. ss. 413-419. doi:10.1073/pnas.13.6.413.
