LDL reseptörü
LDL reseptörü kolesterol zengini LDL'nin endositozuna aracılık eden bir reseptör proteindir. Hücre yüzeyinde bulunan bu reseptör, LDL taneciklerinin fosfolipit dış tabakasında yer alan apoB100 proteinini tanır. Reseptör ayrıca kilomikron kalıntıları ve VLDL kalıntılarında (IDL) bulunan apoE proteini de tanır. Brown ve Goldstein, familyal hiperkolesterolemiyi araştırırken LDL reseptörünü keşfettikleri için bir Nobel Ödülü kazanmışlardır.
Reseptörün fonksiyonu
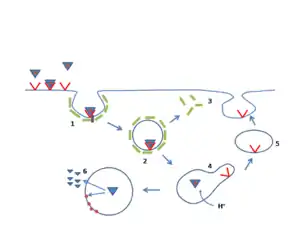
LDL reseptörü hücre yüzeyindeki klatrin kaplı çukurlarda bulunur. Adaptin aracılığıyla LDL'ye bağlandıklarında hücre zarından kopup hücre içinde klatrin kaplı veziküllere dönüşürler. Böylece hücre yüzeyine bağlanmış olan LDL, endositoz yoluyla hücre içine alınmış olur. Bu süreç başlıca karaciğer hücrelerinde olmak üzere ( kan dolaşımındaki LDL'nin %70'i karaciğer tarafından emilir) tüm çekirdekli hücrelerde gerçekleşir. Arter çeperlerindeki hücreler tarafından LDL'in endositozu ve LDL'deki kolesterolun bu hücrelerde birikmesi aterosklerozun başlatır. Ateroskleroz kardiyovasküler hastalıkların çoğunun kökeninde yer alır.
Örtülü veziküller hücre içine alındıktan sonra klatrin örtüsünü atar ve asidik bir geç endozom ile kaynaşır. Ortamın asitliği reseptörün biçiminde bir değişikliğe neden olur ve bunun sonucunda ona bağlı olan LDL salınır. Bunun ardından reseptörler ya imha olur, ya da endositik döngü yoluyla hücre yüzeyine geri gider. Hücre yüzeyindeki nötral pH reseptörün ilk şeklini tekrar almasını sağlar, böylece başka bir LDL taneciğine bağlanmaya hazır hale gelir.
Hücrede reseptörlerin sentezi hücre içindeki serbest kolesterol düzeyi tarafından düzenlenir. Eğer hücrenin ihtiyacından fazla miktarda kolesterol varsa reseptör geninin transkripsiyonu engellenir. LDL reseptörleri endoplazmik retikulumda bulunan ribozomlarda sentezlenir, Golgi aygıtında değişime uğrayıp veziküller içinde hücre yüzeyine giderler.
Reseptörün yapısı
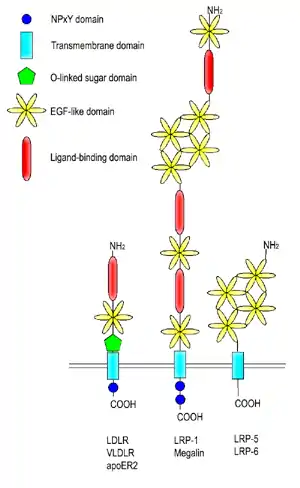
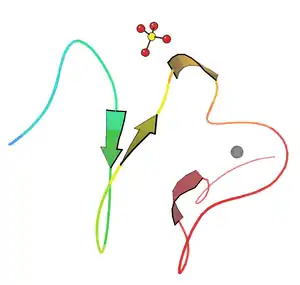
LDL reseptörü karma bir protein olarak tarif edilebilir. Farklı işlevlere sahip ve birbirinden bağımsız olarak çalışabilen bölgelerden oluşur.
LDL reseptörünün N-ucu yedi dizi tekrarından oluşur. Bu dizilerin her biri yaklaşık 40 amino asit uzunluğunda olup altışar sistein içerir, bu tekrarların dizileri birbiri ile %50 oranında aynıdır. Bunların her biri bir ligand bağlayıcı (LB) bölgedir. Her bir tekrar dizisindeki sistein kalıntıları disülfür bağları oluştururlar ve bir kalsiyum iyonunu koordine ederek oktahedral bir örgü (ing. lattice) meydana getirirler. Bu LB bölgeleri ile LDL arasındaki etkileşimin ayrıntıları tam bilinmemekle beraber her bir LB bölgesinin LDL'yi ayrı olarak kavradığı tahmin edilmektedir. ApoB'nin bağlanması 2-7 sayılı tekrar dizilerini gerektirmekte, apoE'nin bağlanması ise yalnızca 5 sayılı tekrar dizisini gerektirmektedir.
Ligand bağlayıcı bölgenin yanı başında epidermal büyüme faktörü öncülü homoloji bölgesi (ing. epidermal growth factor (EGF) precursor homology domain) adlı bölge bulunur. Bu bölge EGF öncül geni ile %30 homoloji gösterir. EGFP bölgesinin reseptöre bağlı ligandın salınma aşamasıyla ilişkili olduğu gösterilmiştir. Endozomdaki asidik (pH 5.0) ortamda reseptörde meydan gelen biçimsel değişiklik bu bölgeyi ligand bağlayıcı 4 ve 5 sayılı tekrar bölgelerine yaklaştırır, bunun sonucunda da LDL reseptörden ayrılır.
Proteinde yer alan üçüncü bir bölge O-bağlantılı oligosakkaritlerle zengindir ama bilinen bir fonksiyonu yoktur. Bu bölgenin eskiden reseptörü hücre dışı matriksten dışarı doğru itmeye yaramış olabileceği öne sürülmüştür.
Proteinin hidrofobik aminoasitlerden oluşan bölümü onun hücre zarına bağlı kalmasını sağlar. Reseptörü hücre içinde kalan C-ucu bölgesinde, onun imali sırasında hücre zarına yollanmasını sağlayan bir sinyal dizisi vardır. Bu bölgede reseptör ile klatrin arasında bir köprü kuran adaptin proteinine bağlanmayı sağlayan bir dizi vardır. Adaptin, LDL reseptörünün klatrin örtülü çukurlarda toplanmasını sağlar.
Hiperkolesterolemi ile bağlantısı
LDL reseptöründeki mutasyonlar beş grup halinde sınıflandırılabilir. Bunların her biri hiperkolesterolemiye neden olabilir:
- Sınıf 1 Endoplazmik retikulumda reseptörün sentezine engel olur.
- Sınıf 2 mutasyonlar reseptörün olgunlaşması için gitmesi gerekn Golgi cihazına taşınmyı engeller.
- Sınıf 3 mutasyonlar LDL'nin reseptöre bağlanmasını engeller.
- Sınıf 4 mutasyonlar reseptör-ligand kompleksinin hücre içine alınmasını engeller.
- Sınıf 5 mutasyonlar içeri alınan reseptörlerin hücre yüzeyine geri gitmesini engeller. Bu mutasyonun doğurduğu fenotip diğerleri kadar ciddi değildir, çünkü hep yeniden sentezlenmesi gerekse de hücre yüzeyinde reseptör vardır.
Kaynakça
- Brown MS, Goldstein JL (1979). "Receptor-mediated endocytosis: insights from the lipoprotein receptor system". Proc. Natl. Acad. Sci. U.S.A. 76 (7). ss. 3330-7. PMID 226968.
- Hobbs HH, Brown MS, Goldstein JL (1993). "Molecular genetics of the LDL receptor gene in familial hypercholesterolemia". Hum. Mutat. 1 (6). ss. 445-66. doi:10.1002/humu.1380010602. PMID 1301956.
- Fogelman AM, Van Lenten BJ, Warden C; ve diğerleri. (1989). "Macrophage lipoprotein receptors". J. Cell Sci. Suppl. Cilt 9. ss. 135-49. PMID 2855802.
- Barrett PH, Watts GF (2002). "Shifting the LDL-receptor paradigm in familial hypercholesterolemia: novel insights from recent kinetic studies of apolipoprotein B-100 metabolism". Atherosclerosis. Supplements. 2 (3). ss. 1-4. PMID 11923121.
- May P, Bock HH, Herz J (2003). "Integration of endocytosis and signal transduction by lipoprotein receptors". Sci. STKE. 2003 (176). ss. PE12. doi:10.1126/stke.2003.176.pe12. PMID 12671190.
- Gent J, Braakman I (2004). "Low-density lipoprotein receptor structure and folding". Cell. Mol. Life Sci. 61 (19-20). ss. 2461-70. doi:10.1007/s00018-004-4090-3. PMID 15526154.
Dış bağlantılar
- Brown - Goldstein laboratuvar Web sitesinde LDL reseptör yolunun betimlemesi27 Eylül 2011 tarihinde Wayback Machine sitesinde arşivlendi. (İngilizce)
Bu madde 'nin çevirisidir.