Hematoksilen-Eozin Boyama
Hematoksilen - Eozin Boyama (Kısaca HxE), rutin incelemelerde ve patoloji laboratuvarlarında vazgeçilmez bir histolojik boyama tekniğidir. Temel prensibi, mavi-mor renk veren hematoksilen ile, pembemsi kırmızı renk veren eozin’in hücreleri boyamasıdır.
Hematoksilen alkali pH'a sahip bir boya maddesi olup hücre çekirdeğini(nükleik asit) ve kalsiyum çöküntülerini boyar. Eozin ise sitoplazma, protein birikimi, amiloid gibi yapıları boyamaktadır. Hematoksilen’in kendisi doğrudan boyama yapmaz. Hematoksilen, oksijenle tepkimeye girerek yani okside olarak aktif formu olan Hemathein’e dönüşür.
HxE boyamada hücrelerin yanı sıra intranüklear, intrasitoplazmik inklüzyon cisimcikleri, bazı sekretorik granüller, amiloid birikimleri, kalsiyum ve kurşun gibi presipitasyonlar görülebilir.
Boya solüsyonlarının hazırlanması
HxE boyamada standart olarak deparafinizasyon ve dehidrasyon için sırasıyla xylol ve dereceli alkol (absolut, %95, %80, %70), hematoksilen solüsyonu, asit alkol, eozin ve yine dereceli alkol serileri ile çıkış xylol’ü bulunur. Farklı amaçlar için değişik hematoksilen solüsyonları hazırlanabilir.
Hematoksilen solüsyonları, Asit hematoksilenler ve Alüminyum hematoksilenler olarak iki sınıfa ayrılır. Rutinlerde kullanılanlar alüminyum hematoksilenler olup bunların başlıca örnekleri; Ehrlich's haematoxylin, Harris's haematoxylin, ve Mayer's haematoxylindir.
Hematoksilen: Haematoxylin, Natural Black 1 veya C.I. 75290 olarak da bilinir. Rutinde en çok Harris’in hematoksileni kullanıldığı için aşağıda bu Hematoksilen solüsyonunun nasıl hazırlanacağı tarif edilmiştir. Kullanılacak kimyasallar:
- Crystal hematoxylen.......................................1 g
- %95’lik Etil alkol............................................10 ml
- Potasyum alum (veya Amonyum alum).............20 g
- Merkürik oksit.................................................0.5 g
- Asetik asit......................................................N/A
1.0 gram Kristal hematoksilen, 10.0 ml %95’lik alkolde çözdürülür. 20.0 gram Potasyum alum (veya Amonyum alum) 200.ml distile suda kaynatılarak çözdürülür. Bu iki ayrı solüsyon yavaş bir şekilde karıştırılır ve elde edilen karışım, koyu mor bir renk alana kadar tekrar kaynatılır. Daha sonra ise karışıma 0.5 gram Merkürik oksit katılır. Karışımın bulunduğu kap alttan 1/3’ü suda kalacak şekilde hızlıca soğutulur. Üzerine birkaç damla Asetik asit katılabilir. Böylece hazırlanan hematoksilen solüsyonu 2 aydan fazla bir süre boyunca kullanılabilir.
Eozin: Eosine-Y ve Eosine-B formunda bulunur. Ancak Eosine-Y (Yellowish, Acid Red 87) daha fazla tercih edilir. Kullanıcak kimyasallar:
- Eosine-Y (Yellowish)
- %95’lik etil alkol
- %80’lik etil alkol
- Glacial acetic acid
- Distile su
1.0 gram Eosine-Y (Yellowish), 20.0 ml distile su içerisinde iyice homojenize olana kadar eritilir. Karışıma, 80.0 ml %95’lik etil alkol eklenir. Bu Stock Eozin’dir. 1 kısım Stock eozin üzerine 3 kısım %80’lik etil alkol eklenirse Working Eozin (boyama işleminde kullanılacak) oluşur. Working eozin üzerine 5 ml Glasiel asetik asit eklenebilir.
Protokol
1. Deparafinizasyon: Dokular, 10ar dakika sürelerle Xylol içerisinde bekletilir.
2. Dehidrasyon: Deparafinize edilmiş dokular sırasıyla Absolut alkol, %95’lik alkol, %80’lik alkol ve %70’lik alkolden 10’ar dakika süreyle geçirilir.
3. Hematoksilen aşaması: Dokular hematoksilene alınıp 5-6 dakika boyunca tutulur.
4. İlk yıkama: Hematoksilenden çıkarılan dokular akan su altında yaklaşık olarak 5-10 dakika boyunca yıkanır.
5. Asit alkol aşaması: Yıkanan dokular asit alkole daldırılıp birkaç saniye soluk mavi renk alana kadar tutulur ve ikinci yıkamaya alınır. 5-10 dakika kadar akan suda yıkanır.
6. Eozin aşaması: İkinci yıkamaya tabi tutulan dokular eozine daldırılıp 3-4 dakika boyunca tutulur.
7. Çıkış alkolü aşaması: Dehidrasyonda olduğu gibidir ancak alkollerin sırası terstir. Dokulardaki fazla eozini uzaklaştırmak için sırasıyla %70, %80, %95 ve absolut alkolden geçirilir. İlk 3 alkole dokular daldırılıp çıkarılırken absolut alkolde 15-20 dakika tutulur.
8. Çıkış Xylol’ü aşaması: Dokular çıkış alkolünden alınır. Birkaç dakika dışarıda kurumaya bırakılır ve çıkış Xylol’üne alınır. 10’ar dakika 3 tane Xylol’den geçirilir.
9. Yapıştırma: Çıkış Xylol’ündeki dokular yapıştırma Xylol’üne alınır. Burada teker teker çıkarılıp sentetik reçine (Entellan) ile yapıştırılıp kurumaya bırakılır.
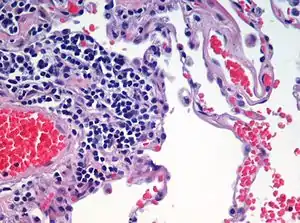
Sonuç
- Hücre çekirdekleri: Koyu mavi-menekşe renkte.
- Sitoplazma: Pembe-kırmızı renkte.
- Bakteri kümeleri: Bulutsu mavi renkte.
Kaynakça
- A Manual of Histological Staining Techniques of the Armed Forces Institute of Pathology,McGraw-Hill, 1968
