Bikarbonat
Bikarbonat, inorganik kimyada, (IUPAC-önerilen isim: hidrojen karbonat[2][3]) karbonik asitin protonsuzlaştırılmasındaki bir ara yapı. HCO3− kimyasal formülene sahip moleküler iyondur.
| Bikarbonat | |
|---|---|
 | |
 | |
Hidroksidodioksidokarbonat(1−)[1] | |
Diğer adlar Hidrojenkarbonat | |
| Tanımlayıcılar | |
| CAS numarası | 71-52-3 |
| PubChem | 769 |
| KEGG | C00288 |
| ChEBI | 17544 |
| SMILES |
|
| Beilstein | 3903504 |
| Gmelin veritabanı | 49249 |
| ChemSpider | 749 |
| 3DMet | B00080 |
| Özellikler | |
| Molekül formülü | CHO3− |
| Molekül kütlesi | 61.0168 g mol−1 |
| log P | −0.82 |
| Asitlik (pKa) | 10.3 (Karbonatın konjuge asiti) |
| Baziklik (pKb) | 7.7 (Karbonik asitin konjuge bazı) |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Bikarbonat, pH tampon sisteminde hayatî derecede önemli biyokimyasal işleve sahiptir.[4]
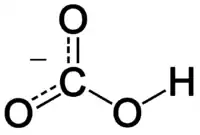
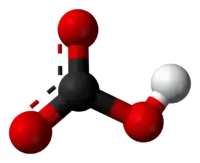
Bikarbonat iyonu bir merkez karbon atomu ve onu üçgensel düzlem (trigonal planar) düzeni ile saran üç oksijen atomu ile beraber bu oksijenlerin birine tutunmuş bir hidrojen atomundan oluşur. Nitrik asit ile izoelektroniktir.Karbonik asitin (H2CO3) konjuge bazı; aynı zamanda karbonat iyonunun konjuge asitidir.Denge reaksiyonları aşağıda gösterilmiştir:
- CO32− + 2 H2O
 HCO3− + H2O + OH−
HCO3− + H2O + OH−  H2CO3 +2 OH−
H2CO3 +2 OH−
- H2CO3 + 2 H2O
 HCO3− + H3O+ + H2O
HCO3− + H3O+ + H2O  CO32− + 2 H3O+.
CO32− + 2 H3O+.
Bikarbonat bileşikleri
- Amonyum bikarbonat
- Kalsiyum bikarbonat
- Karbonik asit
- Magnezyum bikarbonat
- Potasyum bikarbonat
- Sezyum bikarbonat
- Sodyum bikarbonat
Ayrıca bakınız
Kaynakça
- "hydrogencarbonate (CHEBI:17544)". Chemical Entities of Biological Interest (ChEBI). IUPAC Names, UK: European Institute of Bioinformatics. 5 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mart 2016.
- Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, s. 137, 12 Aralık 2019 tarihinde kaynağından (PDF) arşivlendi, erişim tarihi: 28 Mart 2016
- bikarbonat
- "Clinical correlates of pH levels: bicarbonate as a buffer". Biology.arizona.edu. Ekim 2006. 16 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mart 2016.
Dış bağlantılar
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
