Potasyum perklorat
Potasyum perklorat formülü KClO4 olan bir kimyasal bileşiktir. Diğer perkloratlar gibi, bu tuz da güçlü bir oksitleyici olup potansiyel olarak birçok organik maddeyle reaksiyona girer. Havai fişek, mühimmat kapsülleri ve primer patlayıcılarda yaygın bir oksitleyici olarak kullanılan katı ve renksiz kristallerden oluşan bu madde çeşitli şekilde itici yakıtlar, flaş bileşimleri, yıldızlar ve maytaplarda da kullanılmaktadır. Daha yüksek performanslı amonyum perklorat yerine çoğu kez ikame edilerek katı yakıtlı roket itici yakıtı olarak da kullanılmıştır . KClO4 alkali metal perkloratlar içerinde en düşük çözünürlüğe sahiptir(25 °C’deki 100 ml. suda 1.5 gr.).[3]
| Potasyum perklorat | |
|---|---|
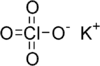 | |
 KClO4 3D top modeli |
 KClO4 boşluk doldurma modeli |
 | |
Diğer adlar Potasyum (VII) klorat; Perklorik asitin potasyum tuzu | |
| Tanımlayıcılar | |
| CAS numarası | 7778-74-7 |
| PubChem | 516900 |
| EC numarası | 231-912-9 |
| UN numarası | 1489 |
| RTECS numarası | SC9700000 |
| SMILES |
|
| InChI |
|
| ChemSpider | 22913 |
| Özellikler | |
| Molekül formülü | KClO4 |
| Molekül kütlesi | 138.55 gr/mol |
| Görünüm | renksiz/ beyaz kristal |
| Yoğunluk | 2.5239 gr/cm3 |
| Erime noktası |
610 °C |
| Kaynama noktası | |
| Çözünürlük (su içinde) | 0.76 gr/100 mL (0 °C) 1.5 gr/100 mL (25 °C)[3] 4.76 g/100 mL (40 °C) 21.08 g/100 mL (100 °C)[4] |
| Çözünürlük () | alkolde çok az çözünür eterde çözünmez |
| Çözünürlük (etanol içinde) | 47 mg/kg (0 °C) 120 mg/kg (25 °C)[4] |
| Çözünürlük (aseton içinde) | 1.6 gr/kg[4] |
| Çözünürlük (etil asetat içinde) | 15 mg/kg[4] |
| Termokimya | |
Standart formasyon entalpisi (ΔfH |
-433 kJ/mol[5] |
Gibbs serbest enerjisi (ΔfG˚) |
-300.4 kJ/mol[4] |
| Tehlikeler | |
| GHS piktogramları |   [2] [2] |
| GHS İşaret sözcüğü | Tehlike |
| R-ibareleri | R9, R22 |
| G-ibareleri | S2, S13, S22, S27 |
| H-ibareleri | H271, H302[2] |
| P-ibareleri | P220[2] |
| NFPA 704 |
 0
1
1
OX
|
| Benzeyen bileşikler | |
Diğer anyonlar |
Potasyum klorür Potasyum klorat Potasyum periyodat |
Diğer katyonlar |
Amonyum perklorat Sodyum perklorat |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Üretimi
KClO4 endüstride sodyum perklorat çözeltisinin KCl ile muamele edilmesiyle imal edilir. Bu tek yönlü çökelme reaksiyonunda NaClO4 çözünürlülüğüne göre KClO4 ‘ın sahip olduğu yaklaşık 100 kez düşük olan çözünürlülüğünden yararlanılır (25 °C’deki 100 ml. suda 209.6 gr.).[6]
- NaClO4 + KCl → KClO4 + NaCl
Yararlanılan kaynaklar
- Benenson, Walter; Stöcker, Horst (2002). Handbook of Physics. Springer. s. 780. ISBN 0387952691. Erişim tarihi: 27 Mayıs 2014.
- Sigma-Aldrich Co., Potassium perchlorate. Retrieved on 2014-05-27.
- "Potassium Perchlorate MSDS". J.T. Baker. 16 Şubat 2007. 3 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Aralık 2007.
- "Arşivlenmiş kopya". 27 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Şubat 2015.
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. s. A22. ISBN 0-618-94690-X.
- Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone “Chlorine Oxides and Chlorine Oxygen Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. DOI:10.1002/14356007.a06_483
Dış bağlantılar
- WebBook page for KClO411 Ekim 2008 tarihinde Wayback Machine sitesinde arşivlendi.