Kalay(II) klorür
Kalay(II) klorür ya da stanit klorür, SnCl2 formülüne sahip, beyaz kristal halinde bir katıdır. Kararlı bir dihidrat oluşturur, ancak sulu çözeltileri, özellikle sıcaksa, hidrolize uğrama eğilimindedir. SnCl2 yaygın bir şekilde indirgeyici madde (bir asit çözeltisi içinde) olarak ve kalay kaplamada elektrolitik banyolarda kullanılır. Kalay (II) klorür, diğer kalay klorür ( kalay(IV) klorür (SnCl4) ile karıştırılmamalıdır.
| Kalay(II) Klorür | |
|---|---|
_chloride.jpg.webp) | |
Tin(II) chloride Tin dichloride | |
Diğer adlar Stanik klorür Kalay tuzu Kalay protoklorür | |
| Tanımlayıcılar | |
| CAS numarası | 7772-99-8, 10025-69-1 |
| PubChem | 24479 |
| UN numarası | 3260 |
| ChEBI | 78067 |
| RTECS numarası | XP8700000 (susuz) XP8850000 (dihidrat) |
| SMILES |
|
| InChI |
|
| ChemSpider | 22887 |
| Özellikler | |
| Molekül formülü | SnCl2 |
| Molekül kütlesi | 189.60 g/mol (susuz) 225.63 g/mol (dihidrat) |
| Görünüm | Beyaz kristal katı |
| Yoğunluk | 3.95 g/cm3 (susuz) 2.71 g/cm3 (dihidrat) |
| Erime noktası |
247 (susuz) (37.7 °C (dihidrat)) |
| Kaynama noktası |
623 (susuz) ((ayrışır)) |
| Çözünürlük (su içinde) | 83.9 g/100 ml (0 °C) Hydrolyses in hot water |
| Çözünürlük () | etanol, aseton, eter, tetrahidrofuranda çözünür ksilende çözünmez |
| Yapı | |
Koordinasyon geometrisi |
Trigonal piramidal (susuz) Dihidrat da üç-koordinelidir |
| Açısal (gaz fazında) | |
| Tehlikeler | |
| Ana tehlikeler | Tahriş edici, su canlılarına zararlı |
| NFPA 704 |
 0
3
0
|
| LD50 | 700 mg/kg (sıçan, oral) 10,000 mg/kg (tavşan, oral) 250 mg/kg (fare, oral) |
| Belirtilmiş yerler dışında verilmiş olan veriler, Standart sıcaklık ve basınçtadır. (25 °C, 100 kPa) | |
| Bilgi kutusu kaynakları | |
Kimyasal yapısı
SnCl2 bir yalnız elektron çiftine sahiptir, gaz fazında molekül bükülür. Katı halde kristal SnCl2, gösterildiği gibi formları zincirleri klorür köprüleri ile zincirler oluşturur. Dihidrat ayrıca üçlü koordinatalıdır; kalay üzerine koordine edilen bir su ve birinciye koordine edilen ikinci bir su. Molekülün ana kısmı, kristal kafesteki çift tabakalar halinde istiflenir ve "ikinci" su, tabakalar arasına sıkıştırılır.
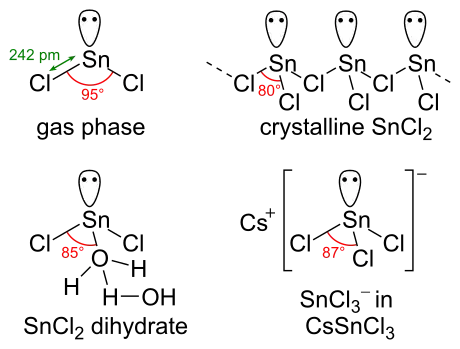
-chloride-xtal-1996-3D-balls-front.png.webp)
Kimyasal özellikleri
Kalay (II) klorür, kendi kütlesinden daha az bir miktarda su kütlesinde çözülebilir, ancak çözelti seyreltildikçe, çözünmeyen bir bazik tuz oluşturmak için hidroliz meydana gelir:
- SnCI2 (aq) + H2O (I)

Bu nedenle, kalay (II) klorür çözeltileri kullanılacaksa, sol tarafa doğru dengeyi korumak için hidroklorik asitte (tipik olarak kalay klorür ile aynı veya daha büyük molarite içinde) çözülmelidir (Le Chatelier ilkesi ). SnCI2 çözeltileri, aynı zamanda hava tarafından oksidasyona karşı kararsızdır.
- 6 SnCI2 (aq) + O2 (g) + 2 H2O (I) 2 SnCl4 (aq) + → 4 Sn(OH)CI (k)
Bu, çözeltiyi kalay metal topaklarının üzerine depolayarak önlenebilir.[2]
Kalay (II) klorürün bir indirgeme maddesi olarak işlev gördüğü, gümüş ve altın tuzlarını metalik forma ve demir (III) tuzlarını demir (II)'ye indirgediği birçok durum vardır, örneğin:
- SnCI2 (aq) + 2 FeCl3 (aq) → SnCl4 (aq) + 2 FeCl2 (aq)
Aynı zamanda bakır (II)'yi bakır (I)'e indirger.
Kalay (II) klorür solüsyonları Sn+2 iyonları kaynağı olarak kullanılabilir, böylece çökelme reaksiyonları ile diğer kalay (II) bileşikleri oluşturabilir. Örneğin, sodyum sülfür ile reaksiyonu kahverengi/siyah kalay (II) sülfür üretir.
- SnCI2 (aq) + Na2S (aq) → SNS (k) + 2 NaCI (aq)
Eğer SnCI2, solüsyonlarına alkali eklenirse hidratlanmış bir beyaz kalay (II) oksit çökeltisi oluşturur; bu daha sonra, fazla bazda sodyum stanit gibi stanit tuzları oluşturur.
- SnCI2 + SnO → (aq) + 2 NaOH (aq) · H2O (k) + 2 NaCI (aq)
- SnO · H2O (k) + NaOH (aq) → NaSn(OH)3 (aq)
Susuz SnCl2, susuz çözücü içinde ilginç kalay (II) bileşikleri oluşturmada kullanılır. Örneğin, lityum tuzu ve 4-metil-2,6-di-tert-bütilfenol içinde SnCl2 ile reaksiyona girer THF vermek üzere sarı bir doğrusal, iki koordinatlı bileşik Sn (OAr) 2 (Ar = aril ) oluşturur.[3]
Kalay (II) klorür ayrıca bir Lewis asidi gibi davranır, örneğin klorür iyonu gibi ligandlarla kompleksler oluşturur:
- SnCI2 (aq) + CsSnCl3 (aq) → CsCI (aq)
Bu komplekslerin çoğu piramit yapılıdır ve SnCI3 gibi kompleksler tam oktete sahip olduğu için, birden fazla ligant eklemek için az miktarda bir eğilim vardır. Bununla birlikte, bu tür komplekslerde yalnız elektron çifti bağlanma için mevcuttur ve bu nedenle kompleksin kendisi bir Lewis bazı veya ligand olarak hareket edebilir. Bu, aşağıdaki reaksiyonla ferrosen ile ilgili ürününde görülür:
- SnCI2 + Fe(η5-C5H5)(CO)2HgCl → Fe(η5-C5H5)(CO)2SnCl3 + Hg
SnCl2, metal-metal bağı ihtiva eden bileşikler gibi çeşitli bileşikler yapmada kullanılabilir. Örneğin, dikobalt oktakarbonil ile reaksiyonu:
- SnCl2 + Co2(CO) 8 → (CO)4Co-(SnCI2)-Co(CO)4
Hazırlanması
Susuz SnCl2 metalik kalay üzerindeki kuru hidrojen klorürün etkisi ile hazırlanmaktadır. Dihidrat, hidroklorik asit kullanılarak benzer bir reaksiyonla yapılır.
- Sn (k) + 2 HCI (aq) → SnCI2 (aq) + H2 (g)
Su, daha sonra dikkatli bir şekilde asidik çözeltiden buharlaştırılır ve SnCI2·2H2O kristalleri üretilir. Bu dihidrat, asetik anhidrid kullanılarak susuzlaştırılabilir.[4]
Kullanımları
Teneke kutular yapmak için çeliğin teneke kaplaması için az miktarda hidroklorik asit içeren bir kalay (II) klorür çözeltisi kullanılır. Bir elektrik potansiyeli uygulanır ve elektroliz yoluyla katotta kalay metali oluşturulur.
Kalay (II) klorür tekstil boyamada mordan olarak kullanılır, çünkü bazı boyalarla, örneğin kokineal ile daha parlak renkler verir. Bu mordan aynı zamanda ipeğin ağırlığını arttırmak için de kullanılmıştır.
Plastik polilaktik asit (PLA) üretiminde katalizör olarak kullanılır.
Aynı zamanda, aseton peroksitin tetramerik formunu oluşturmak için aseton ve hidrojen peroksit arasında bir katalizör olarak bir kullanım bulmaktadır.
Kalay (II) klorür ayrıca bir indirgeyici madde olarak geniş kullanım alanı bulur. Bu, gümüş metalin cam üzerine biriktirildiği gümüşleme aynalarında kullanımında görülür:
- Sn2+ (aq) + 2 Ag+ → Sn4+ (aq) + 2 Ag (k)
İlgili bir indirgenme geleneksel olarak Hg2+ (aq) için analitik bir test olarak kullanılmıştır. Örneğin SnCl2 damla damla cıva (II) klorür çözeltisi içine eklenirse, beyaz bir cıva (I) klorür çökeltisi oluşturulur; daha fazla SnCl2 eklendiğinde metalik cıva oluştuğu için kararır. Stanik klorür, altın bileşiklerinin varlığını test etmek için kullanılabilir. SnCl2, altın varlığında parlak maviye döner (bkz . Cassius Moru ).
Cıva, atomik absorpsiyon spektroskopisi kullanılarak analiz edildiğinde, soğuk bir buhar yöntemi kullanılmalıdır ve indirgeyici olarak kalay (II) klorür kullanılır.
Organik kimyada, SnCl2 esas olarak Stephen indirgenmesinde kullanılır, nitril, imine indirgenir (bir imidoil klorür tuzu ile) sonrasında aldehite kolayca hidrolize edilir.[5]
Reaksiyon genellikle aromatik nitriller Aril-CN ile en iyi şekilde çalışır. İlgili bir reaksiyon (Sonn-Müller metodu olarak adlandırılır), imidoil klorür tuzunu oluşturmak için PCl 5 ile muamele edilen bir amid ile başlar.
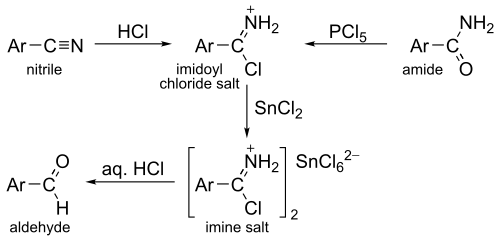
Stephen indirgemesi bugün daha az kullanılmaktadır, çünkü çoğunlukla diizobutilalüminyum hidrit indirgemesi ile değiştirilmiştir.
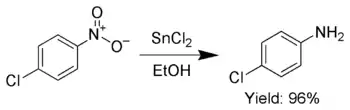
Buna ek olarak, SnCl2 seçici olarak aromatik nitro grupları anilinlere indirgemek için kullanılır.[6]
SnCl2 ayrıca kinonları hidrokinonlara indirger.
Stanik klorürler ayrıca bazı konserve ve şişeli gıdalara E numarası E512 içeren bir gıda katkı maddesi olarak ilave edilir, burada bir renk tutma ajanı ve antioksidan olarak işlev görür.
SnCl2 radyonüklid anjiyografi radyoaktif madde teknesyum -99m- perteknetatı indirgemek ve kan hücrelerine bağlamaya yardımcı olmak için kullanılır.
Sulu kalay klorür, rafine değerli metal kullanan hobiciler ve profesyoneller tarafından çözeltilerde altın ve platin grubu metallerinin bir göstergesi olarak kullanılır.
Erimiş SnCl2 yüksek kristal SnO2 nanoyapıları oluşturmak üzere oksitlenebilmektedir.[7][8]
Notlar
- J. M. Leger; J. Haines; A. Atouf (1996). "The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl2". J. Phys. Chem. Solids. 57 (1): 7–16. Bibcode:1996JPCS...57....7L. doi:10.1016/0022-3697(95)00060-7
- H. Nechamkin (1968). The Chemistry of the Elements. New York: McGraw-Hill.
- B. Cetinkaya, I. Gumrukcu, M. F. Lappert, J. L. Atwood, R. D. Rogers and M. J. Zaworotko (1980). "Bivalent germanium, tin, and lead 2,6-di-tert-butylphenoxides and the crystal and molecular structures of M(OC6H2Me-4-But2-2,6)2 (M = Ge or Sn)". J. Am. Chem. Soc. 102 (6): 2088–2089. doi:10.1021/ja00526a054.
- W. L. F. Armarego; C. L. L. Chai (2009). Purification of laboratory chemicals (6 ed.). The United States of America: Butterworth-Heinemann.
- Williams, J. W. (1955)."β-Naphthaldehyde 4 Şubat 2019 tarihinde Wayback Machine sitesinde arşivlendi.". Organic Syntheses; Collective Volume, 3, p. 626
- F. D. Bellamy & K. Ou (1984). "Selective reduction of aromatic nitro compounds with stannous chloride in non acidic and non aqueous medium". Tetrahedron Letters. 25 (8): 839–842. doi:10.1016/S0040-4039(01)80041-1
- A.R.Kamali, Thermokinetic characterisation of tin(11) chloride, J Therm Anal Calorim 118(2014) 99-104.
- A.R.Kamali et al.Transformation of molten SnCl2 to SnO2 nano-single crystals, Ceram Intern 40 (2014)8533-8538.
Kaynakça
- NN Greenwood, A. Earnshaw, Elementlerin Kimyası , 2. baskı, Butterworth-Heinemann, Oxford, İngiltere, 1997.
- Kimya ve Fizik El Kitabı , 71. baskı, CRC Press, Ann Arbor, Michigan, 1990.
- Merck Index , 7. basım, Merck & Co, Rahway, New Jersey, ABD, 1960.
- AF Wells, ' Yapısal İnorganik Kimya , 5. basım, Oxford University Press, Oxford, İngiltere, 1984.
- J. March, Advanced Organic Chemistry , 4. baskı, s. 723, Wiley, New York, 1992.